
科目: 来源: 题型:解答题
 ,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.
,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.
查看答案和解析>>
科目: 来源: 题型:解答题
 四氧化三锰(Mn3O4)在电子工业有广泛应用.
四氧化三锰(Mn3O4)在电子工业有广泛应用.| 序号 | 反应 | △H(kJ•mol-1) | K | |
| 300°C | 800°C | |||
| Ⅰ | MnCO3(s)+$\frac{1}{2}$O2(g)?MnO2(s)+CO2(g) | a | 3.0×107 | 1.8×105 |
| Ⅱ | MnCO3(s)+$\frac{1}{4}$O2(g)?$\frac{1}{2}$Mn2O3(s)+CO2(g) | b | 1.7×103 | 2.4×105 |
| Ⅲ | MnCO3(s)+$\frac{1}{6}$O2(g)?$\frac{1}{3}$Mn3O4(s)+CO2(g) | c | 9.8 | 9.6×104 |
查看答案和解析>>
科目: 来源: 题型:解答题
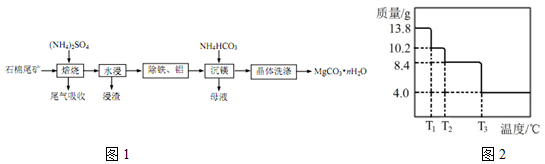
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 .
. +nCO2$\stackrel{催化剂}{→}$
+nCO2$\stackrel{催化剂}{→}$

查看答案和解析>>
科目: 来源: 题型:选择题
 常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示,下列叙述正确的是( )
常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示,下列叙述正确的是( )| A. | Ka1(H2X)的数量级为10-7 | |
| B. | 曲线N表示lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$与pH的变化关系 | |
| C. | NaHX溶液中:c(H+)<c(OH-) | |
| D. | 当混合溶液呈中性时:c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
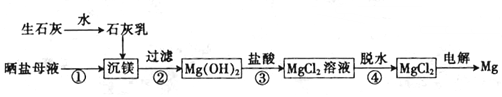
| A. | 上述工艺流程中未涉及置换反应 | |
| B. | 设计步骤①、②、③的主要目的是富集MgCl2 | |
| C. | 脱水时在HCl气氛中进行可防止MgCl2发生水解 | |
| D. | 电解得到的炽热镁粉可在二氧化碳气氛中冷却 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别向饱和NaHCO3溶液和饱和NaHSO3溶液中滴加几滴酚酞试剂 | 前者溶液不变色,后者溶液变红 | 非金属:S>C |
| B | 甲烷与氯气的混合气在光照下反应,用湿润的蓝色石蕊试纸检验反应后生成的气体 | 湿润的蓝色石蕊试纸变红 | 甲烷的氯代物呈酸性 |
| C | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是HCl |
| D | 向溴水中通入SO2 | 溴水橙黄色褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 组别 | 甲 | 乙 | 丙 |
| A | NH3 | CuO | 稀HNO3 |
| B | Al | 盐酸 | Fe2O3 |
| C | Si | O2 | H2 |
| D | SO2 | NaOH溶液 | 新制氯水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水 | |
| B. | 实验时,应先加热管式炉,再打开盛装稀硫酸的分液漏斗 | |
| C. | 为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液 | |
| D. | 该实验中制备氢气的装置也可用于氢氧化钠稀溶液与氯化铵固体反应制备氨气 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ①、③互为同分异构体 | B. | ②的分子式为C10H18O | ||
| C. | ①能使酸性高锰酸钾溶液褪色 | D. | ①、②、③都能与金属钠反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com