
科目: 来源: 题型:选择题

| A. | X、Y、Z三种元素的原子半径,Z的原子半径最小 | |
| B. | X和Y的单质(已除去表面氧化膜且形状完全一样)分别与等浓度的稀硫酸反应时,前者反应明显比后者剧烈 | |
| C. | 同分异构现象的广泛存在是含N的化合物种类繁多的原因之一 | |
| D. | M的氢化物的酸性比Z的氢化物强,因此M的气态氢化物比较稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
 短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍.n、p、q是由这些元素组成的二元化合物,常温下,n为气体.m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示.下列说法正确的是( )| A. | 简单离子半径:Z>Y>X | |
| B. | 化合物P中只存在离子键 | |
| C. | 图示转化关系涉及的反应均为氧化还原反应 | |
| D. | 最简单气态氢化物的稳定性:W>X |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该有机物的分子式为C25H24 | |
| B. | 最多可能有5个碳原子在同一直线上 | |
| C. | 该分子中最多可能有13个碳原子在同一平面上 | |
| D. | 该有机物能使酸性高锰钾溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | C2H6 C3H6 C4H6 | ||
| C. | CH4 C2H6 C3H8 | D. | C2H4 C2H2 CH4 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2═CH2+Br2→CH2Br-CH2Br | B. | B、CH3CH2OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | ||
| C. |  | D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |
查看答案和解析>>
科目: 来源: 题型:多选题
 一定温度下,在三个体积均为2.0L的恒容密闭容器中发生反应:
一定温度下,在三个体积均为2.0L的恒容密闭容器中发生反应:| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | |||
| CO(g) | H2(g) | CH3OCH3(g) | CO2(g) | ||
| Ⅰ | T1 | 0.10 | 0.10 | 0 | 0 |
| Ⅱ | T1 | 0 | 0 | 0.10 | 0.10 |
| Ⅲ | T2 | 0.10 | 0.10 | 0 | 0 |
| A. | 达到平衡时,容器I中的逆反应速率大于容器Ⅲ中的正反应速率 | |
| B. | 达到平衡时,容器I中CO的转化率与容器Ⅱ中CO2的转化率之和小于I | |
| C. | 达到平衡时,容器Ⅱ中c(CO2)大于容器Ⅲ中c(CO2)的3倍 | |
| D. | 若起始时向容器Ⅲ中充入四种反应物质且物质的量均为0.04mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.
.②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.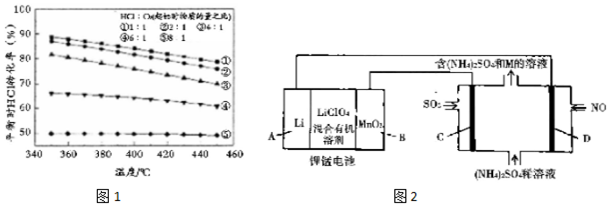
查看答案和解析>>
科目: 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目: 来源: 题型:解答题
 物质结构决定物质性质,回答下列涉及物质结构和性质的问题.
物质结构决定物质性质,回答下列涉及物质结构和性质的问题. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com