
科目: 来源: 题型:选择题
| A. | 蒸馏 | B. | 冷却结晶 | C. | 重结晶 | D. | 蒸发结晶 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
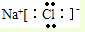 .
.查看答案和解析>>
科目: 来源: 题型:解答题

 ,另外一种生成物的化学式为Na2MoO4
,另外一种生成物的化学式为Na2MoO4查看答案和解析>>
科目: 来源: 题型:解答题
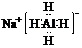 ,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用干燥的有色布条检验 | B. | 将气体通入硝酸银溶液 | ||
| C. | 用干燥的蓝色石蕊试纸检验 | D. | 用湿润的碘化钾淀粉试纸检验 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液常用于自来水的杀菌消毒 | |
| D. | 离子半径:r(Z-)>r(W3+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com