
科目: 来源: 题型:填空题

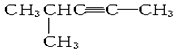 分子式为C5H8,名称是4-甲基-1-戊炔,
分子式为C5H8,名称是4-甲基-1-戊炔,查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NO2与水反应:3NO2+H2O═2NO3-+NO+2H+ | |
| B. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+═SO2↑+H2O | |
| C. | 氨水吸收NO、NO2:NO+NO2+2OH-═2NO2-+H2O | |
| D. | NH4HCO3溶于过量浓NaOH溶液中:NH4++OH-═NH3↑+H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向浓氨水中滴加饱和 FeCl3溶液,可以制得 Fe(OH)3胶体 | |
| B. | 为除去Mg(OH)2固体中少量Ca(OH)2,可用饱和 MgCl2溶液多次洗涤,再水洗、干燥 | |
| C. | 向溶液X中加入足量盐酸,产生无色无味气体,将气体通入澄清石灰水,产生白色沉 淀,说明溶液 X 中含有 CO32- | |
| D. | 卤代烃Y与NaOH醇溶液共热后,恢复至室温,再滴加AgNO3溶液,产生白色沉淀,说明卤代烃 Y 中含有氯原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 银针复原发生的反应可能为:3Ag2S+2Al=6Ag+Al2S3 | |
| B. | 当银针变黑时,所检验的物质有毒 | |
| C. | 银针验毒时,Ag被氧化 | |
| D. | 上述验毒反应的氧化产物和还原产物的物质的量之比为1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是 2:1 | |
| B. | 该浓硝酸中 HNO3 的物质的量浓度是 14.0 mol/L | |
| C. | NO2 和 N2 O4 的混合气体中,NO2 的体积分数是 80% | |
| D. | 得到 2.54 g 沉淀时,加入 NaOH 溶液的体积是 600 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com