
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | X、Y都存在同素异形现象 | |
| B. | 工业上常用W的氧化物为原料制取单质W | |
| C. | Z和Y形成的化合物中只存在离子键 | |
| D. | 常温下单质W不能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去.
Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去.查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积(Ksp) | 1.4×10-10 | 1.4×10-5 | 1.4×10-50 | 1.4×10-13 | 1.4×10-16 |
| A. | 在AgCl、Ag2SO4、AgBr、AgI饱和溶液中分别滴加Na2S溶液,均会生成相同的沉淀 | |
| B. | 25℃时,5种银盐饱和溶液中c(Ag+)最大的是Ag2SO4饱和溶液 | |
| C. | 25℃时,在等物质的量浓度的NaCl溶液和CaCl2溶液中加入足量的AgCl固体,形成饱和溶液,两溶液中AgCl溶度积相同,但c(Ag+)不同 | |
| D. | AgBr沉淀可转化为AgI沉淀,而AgI沉淀不可能转化为AgBr沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
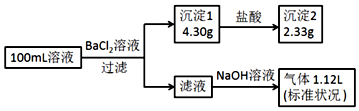
| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 原溶液一定存在Cl-和Na+ | |
| C. | 原溶液中c(Cl-)≥0.2mol•L-1 | |
| D. | 若原溶液中c(NH4+)=0.05mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.4 |

查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,一些金属离子(用Mn+表示)形成M(OH)n沉淀与溶液pH平衡关系曲线如图.已知:c(Mn+)≤1×10-5 mol•L-1时可认为金属离子沉淀完全;pM=-lgc(Mn+),pKsp=-lgKsp.下列叙述正确的是( )
常温下,一些金属离子(用Mn+表示)形成M(OH)n沉淀与溶液pH平衡关系曲线如图.已知:c(Mn+)≤1×10-5 mol•L-1时可认为金属离子沉淀完全;pM=-lgc(Mn+),pKsp=-lgKsp.下列叙述正确的是( )| A. | Mn+开始沉淀的pH与起始溶液c(Mn+)无关 | |
| B. | 不同的金属沉淀完全时的pH相同 | |
| C. | 图中Y点与X点pKsp不相同 | |
| D. | Y点:pM=pKsp+npH-14n |
查看答案和解析>>
科目: 来源: 题型:填空题
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com