
科目: 来源: 题型:选择题
| A. | 过量的稀硝酸与碳酸钠 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18mol/L硫酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HClO3 | B. | H2SeO3 | C. | H3BO3 | D. | HMnO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子中不能含有氢原子 | |
| B. | 在ABn型分子中A的相对原子质量应小于B的相对原子质量 | |
| C. | 在ABn型分子中A原子最外层没有孤对电子,即价电子全部成键 | |
| D. | 分子中每个共价键的键长应相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室制备环己酮的反应原理:
实验室制备环己酮的反应原理: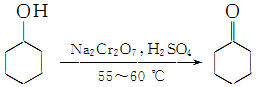 (实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1 | 0.962 | 能溶于水 |
| 环己酮 | 155.6 | 0.948 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 | - |
| 水 | 100.0 | 0.998 | - |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通过酸性高锰酸钾溶液 | B. | 通过澄清石灰水 | ||
| C. | 通过饱和Na2CO3溶液 | D. | 通过氢氧化钠溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途.回答下列问题:
铜是重要的金属,广泛应用于电气、机械制造、国防等领域,铜的化合物在科学研究和工农业生产中有许多用途.回答下列问题:
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示装置,可观察到电流计指针偏转,M棒变粗,N棒变细.表所列M、N、P物质中,可以组合成该装置的是( )
如图所示装置,可观察到电流计指针偏转,M棒变粗,N棒变细.表所列M、N、P物质中,可以组合成该装置的是( )| A | B | C | D | |
| M | 锌 | 铜 | 银 | 锌 |
| N | 铜 | 铁 | 锌 | 铁 |
| P | 稀H2SO4 | 稀盐酸 | AgNO3溶液 | Fe(NO3)3溶液 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com