
科目: 来源: 题型:选择题
 氯碱工业中离子交换膜电解槽示意图如下图,其中的离子交换膜为“阳离子交换膜”,它有一特殊的性质:只允许阳离子通过,而阻止阴离子和气体通过.下列说法正确的是( )
氯碱工业中离子交换膜电解槽示意图如下图,其中的离子交换膜为“阳离子交换膜”,它有一特殊的性质:只允许阳离子通过,而阻止阴离子和气体通过.下列说法正确的是( )| A. | e口流入的是精制食盐水;f口流入的是蒸馏水 | |
| B. | a口流出的是稀食盐水,d口流出的是氢氧化钠溶液 | |
| C. | b为氯气,c为氧气 | |
| D. | b与a口流出的溶液可制得漂白液 |
查看答案和解析>>
科目: 来源: 题型:解答题
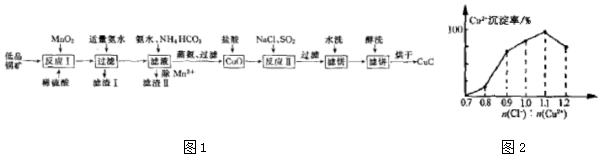
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3、③NaAlO2溶液中c(Na+):③>②>① | |
| B. | 将0.2mol•L-1NaHCO3溶液与0.1mol•L-1KOH溶液等体积混合:3c(K+)+c(H+)═c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 | |
| D. | 向AgCl和AgBr的等体积饱和溶液中加入足量AgNO3溶液,则AgCl沉淀多于AgBr沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该装置将化学能转化为电能 | |
| B. | 催化剂b表面O2发生还原反应,其附近酸性增强 | |
| C. | 催化剂a表面的反应是:SO2+2H2O-2e-═SO42-+4H+ | |
| D. | 若通入的H2O和SO2比例合适,得到的硫酸质量分数可能仍为49% |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O | |
| B. | 为了提高Ni的产率,电解过程中需要控制废水pH | |
| C. | 电解过程中,B中NaCl溶液的物质的量浓度将不断增大 | |
| D. | 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式不会发生改变 |
查看答案和解析>>
科目: 来源: 题型:解答题

| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
查看答案和解析>>
科目: 来源: 题型:解答题
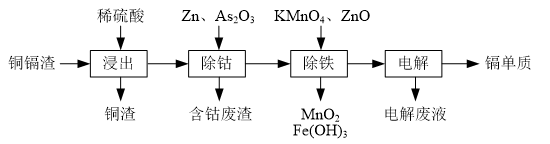
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | M为电子流出的一极 | |
| B. | 通电使氯化钠发生电离 | |
| C. | 电解一段时间后,阴极区pH降低 | |
| D. | 电解时用盐酸调节阳极区的pH在2~3,有利于气体逸出 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 甲烧杯中溶液的pH降低 | |
| B. | 电解一段时间后,将甲、乙两溶液混合,一定会产生沉淀 | |
| C. | 当b极增重5.4g时,d极产生的气体为2.24L(标况) | |
| D. | 乙烧杯中的d电极反应式为Fe-2e-=Fe2+ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com