
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.58 | 38.0 | 55.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
 某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列 说法正确的是( )
某温度时,AgCl(s)?Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示.下列 说法正确的是( )| A. | 加入 AgNO3 可以使溶液由 c 点变到 d 点 | |
| B. | 加入固体 NaCl,则 AgCl 的溶解度减小,Ksp 也减小 | |
| C. | d 点有 AgCl 沉淀生成 | |
| D. | a 点对应的 Ksp小于 b 点对应的 Ksp |
查看答案和解析>>
科目: 来源: 题型:选择题
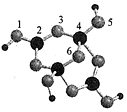
| A. | 在Xm-中,硼原子轨道的杂化类型有sp2、sp3 | |
| B. | 配位键存在于4、5原子之间 | |
| C. | m=3 | |
| D. | 硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有共价键、范德华力、氢键 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 7.2 | 5.9 |
| 沉淀完全的pH | 3.3 | 9.9 | 8.9 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4mol 35% | B. | 2mol 30% | C. | 2mol 70% | D. | 1mol 15% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 取样,加入稀硝酸酸化的Ba(NO3)2溶液 | |
| B. | 取样,先加稀硝酸酸化,再加Ba(NO3)2溶液 | |
| C. | 取样,先加盐酸酸化,再加BaCl2溶液 | |
| D. | 取样,加入盐酸酸化的BaCl2溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知含铜离子的颜色主要有Cu(H2O)42+(蓝色)、CuCl42-(黄色)、Cu(NH3)42+(深蓝色)等.
已知含铜离子的颜色主要有Cu(H2O)42+(蓝色)、CuCl42-(黄色)、Cu(NH3)42+(深蓝色)等.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com