
科目: 来源: 题型:选择题
| A. | 28g乙烯和环丁烷(C4H8)的混合气体含有的碳原子数为2NA | |
| B. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| D. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 | |
| B. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO | |
| C. | SiO2既能和氢氧化钠溶液反应也能和氢氟酸反应,所以是两性氧化物 | |
| D. | 将浓硫酸滴到蔗糖表面,固体变黑膨胀,说明浓硫酸有脱水性和强氧化性 |
查看答案和解析>>
科目: 来源: 题型:实验题
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.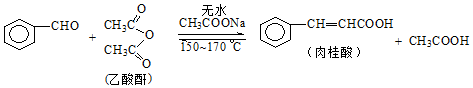
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |

查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| B. | 室温下1mL pH=1的盐酸与100mL NaOH溶液混合后溶液的pH=7,则NaOH溶液的pH=11 | |
| C. | 浓度均为0.1mol/L的CH3COOH与CH3COONa混合溶液(pH=5.6)中,c(Na+)>c(CH3COO-) | |
| D. | 0.1mol•L-1的碳酸氢钠溶液中:c(Na+)=c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目: 来源: 题型:解答题



查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com