
科目: 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
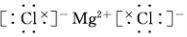 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH4$\stackrel{高温}{→}$C+2H2 | |
| B. | CH3CH═CH2+Br2$\stackrel{CCI_{1}}{→}$CH3CHBrCH2Br | |
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| D. | Cl2+C2H6$\stackrel{光}{→}$C2H5Cl+HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子数不同 | B. | 质子数相同 | C. | 氧原子数相同 | D. | 气体质量相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
 .
. 或
或
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa 下,n(NH3)和 n(H2)随时间 t 变 化的关系示意图如图所示.下列叙述中正确的是( )
合成氨工业对国民经济和社会发展具有重的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),673K、30MPa 下,n(NH3)和 n(H2)随时间 t 变 化的关系示意图如图所示.下列叙述中正确的是( )| A. | c 点处正反应速率和逆反应速率相等 | |
| B. | a 点处正反应速率比 b 点处的大 | |
| C. | d 点(t1 时刻)和 e 点(t2 时刻)处 n(N2)不同 | |
| D. | t2 时刻,正反应速率大于逆反应速率 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
 实验室用无水酒精和浓硫酸(体积比1:3)的混合加热制乙烯气体.某学习小组设计了如图所示装置,用于制取乙烯并验证乙烯的性质.
实验室用无水酒精和浓硫酸(体积比1:3)的混合加热制乙烯气体.某学习小组设计了如图所示装置,用于制取乙烯并验证乙烯的性质.查看答案和解析>>
科目: 来源: 题型:解答题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | E | F | G | R | ||||
| 3 | B | C | D | H |
查看答案和解析>>
科目: 来源: 题型:解答题
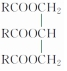 ”来表示,其中R为碳原子数目多于10的链烃基,可以相同也可以不同.分子式为C51H92O6的某油脂在稀硫酸中加热水解后得到A、B两种物质,若A的相对分子质量为92(已知:R1-CH═CH-R2$→_{H+}^{KMnO_{4}}$R1-COOH+R2-COOH),则
”来表示,其中R为碳原子数目多于10的链烃基,可以相同也可以不同.分子式为C51H92O6的某油脂在稀硫酸中加热水解后得到A、B两种物质,若A的相对分子质量为92(已知:R1-CH═CH-R2$→_{H+}^{KMnO_{4}}$R1-COOH+R2-COOH),则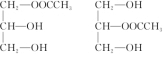 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com