
科目: 来源: 题型:解答题
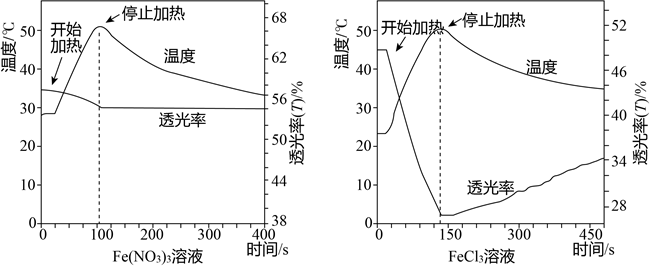
| 编号 | 实验 | 操作及现象 |
| a | 向Fe(NO3)3溶液(棕黄色)中加入大量HNO3 | i.溶液颜色非常浅 ii.加热和降温过程中透光率无明显变化 |
| b | 向FeCl3溶液(黄色)中加入大量HNO3 | i.溶液仍为黄色 ii.加热透光率下降,降温透光率上升 |
| 编号 | 实验 | 操作及现象 |
| c | 向Fe(NO3)3溶液中加入大量HNO3,再加入几滴NaCl溶液. | 测此溶液透光率随温度改变的变化情况,增加氯离子浓度,有色离子浓度增加 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 砷的一些化合物常用作半导体、除草剂、杀鼠药等.回答下列问题:
砷的一些化合物常用作半导体、除草剂、杀鼠药等.回答下列问题:
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 反应 装置或 图象 |  |  |  |  |
| 实验现 象或图 像信息 | 反应开始 后,针筒活 塞向右移动 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 温度计的 水银柱不 断上升 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | 金属性由强到弱的顺序为:Z、W | |
| B. | 原子半径由大到小的顺序为:Y、Z | |
| C. | 简单气态氢化物的稳定性由强到弱的顺序:X、Y | |
| D. | 工业上常用电解熔融Z的氧化物得到单质Z |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题

 ;在④⑤⑦三种元素中,简单离子半径最大的是S2-(用离子符号表示).
;在④⑤⑦三种元素中,简单离子半径最大的是S2-(用离子符号表示). .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 油脂能在碱性条件下水解,可用于工业上制取肥皂 | |
| B. | 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘 | |
| C. | 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂 | |
| D. | 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com