
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ②③⑥ | D. | ④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为6H2O+6e-═6OH-+3H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2Cl-+2e-=Cl2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 大量使用含磷洗衣粉会造成生活污水的富营养化 | |
| B. | 用未经处理的电镀厂废水灌溉农田,易造成土壤重金属污染 | |
| C. | 臭氧一生物活性炭用于自来水深度处理,利用了活性炭的还原性 | |
| D. | 纳米铁粉可将地下水中的NO3-转化为N2,是因为纳米铁具有还原性 |
查看答案和解析>>
科目: 来源: 题型:解答题

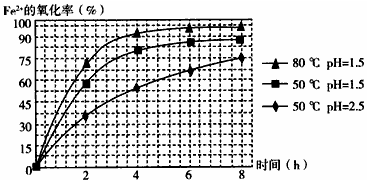
查看答案和解析>>
科目: 来源: 题型:选择题
 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )| A. | 原溶液中一定含有的阳离子是H+、NH4+、Fe3+、Al3+ | |
| B. | 原溶液中一定含有SO42- | |
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | |
| D. | 反应最后形成的溶液中溶质为Na2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
 298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )| A. | 298K 时,0.1mol•L-1HX 溶液中HX的电离度为1% | |
| B. | V=10mL时,同时微热溶液(忽略体积变化),$\frac{c({X}^{-})}{c({Y}^{-})}$逐渐增大 | |
| C. | V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) | |
| D. | 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
 常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列说法中,不正确的是( )
常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列说法中,不正确的是( )| A. | HA为一元强酸 | |
| B. | MOH 为一元弱碱 | |
| C. | N点水的电离程度小于K点水的电离程度 | |
| D. | 若K点对应溶液有c(MOH)+c(M+)=2C(A_) |
查看答案和解析>>
科目: 来源: 题型:解答题

| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大.E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态.请回答下列问题:
E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大.E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com