
科目: 来源: 题型:选择题
| A. | X、Y形成的具有10e-的分子中含非极性共价键 | |
| B. | X单质和Z单质在暗处剧烈反应形成的化合物比HCl稳定 | |
| C. | 含W元素的盐溶液一定显酸性 | |
| D. | Z离子半径小于W离子半径 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向Al(OH)3沉淀滴加NaOH或盐酸沉淀均消失,说明Al(OH)3是两性氢氧化物 | |
| B. | 饱和Na2S溶液中滴入少量氯水出现浑浊,说明元素非金属性Cl>S | |
| C. | 将铜丝插入锌粒与稀硫酸反应体系中反应明显加快,原因是形成了原电池 | |
| D. | 饱和食盐水中滴入浓硫酸析出食盐晶体,说明浓硫酸吸水放出大量的热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | υ(N2生成)=3υ(H2消耗) | |
| B. | H2、H2、HN3的分子数之比为1:3:2 | |
| C. | 单位时间内生成2molNH3,同时消耗1molH2 | |
| D. | 容器内的压强不再变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
 (a、b、c均大于零)
(a、b、c均大于零)| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 断开1molH-H键和1molI-I键所需能量大于断开2molH-I键所需能量 | |
| C. | 断开2molH-I键所需能量约为(c+b+a)kJ | |
| D. | 向密闭容器中加入2molH2和2molI2,充分反应放出的热量大小2akJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| S | Cl |
| Se | Br |
| A. | 还原性:Se2->S2->Cl- | B. | 热稳定性:HCl>H2Se>HBr | ||
| C. | 原子半径:Se>Cl>S | D. | 酸性:HBrO4>HClO4>H2SeO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 上述反应中氮气作还原剂 | |
| B. | 氮氧化铝中氮元素的化合价是-3 | |
| C. | 氮氧化铝晶体中的作用力是范德华力 | |
| D. | 根据氮氧化铝晶体的硬度可推断其晶体类型可能与石英相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 11.2g | B. | 2.8g | C. | 5.62g | D. | 无法计算 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 含不溶性杂质的粗苯甲酸进行重结晶分离的操作步骤之一是趁热过滤 | |
| C. | 做银镜反应实验后,用硝酸洗涤试管壁上的银镜 | |
| D. | 制备乙酸乙酯时,先向大试管中加入浓硫酸,再逐滴加入乙醇和乙酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
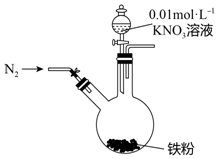 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验步骤及现象如下:| 实验步骤 | 实验现象 |
| 1.打开弹簧夹,缓慢通入N2 | |
| 2.加入pH为2.5的0.01mol/L酸性KNO3溶液100mL | 铁粉部分溶解,溶液呈浅绿色; 铁粉不再溶解后,剩余铁粉表面出现少量白色物质附着. |
| 3.反应停止后,拔掉橡胶塞,将圆底烧瓶取下 | 烧瓶内气体的颜色没有发生变化. |
| 4将剩余固体过滤 | 表面的白色物质变为红褐色. |
| 实验步骤 | 实验现象 |
| 1.取部分滤液于试管中,向其中加入KSCN溶液 | 溶液液无变化 |
| 2.将上述溶液分为两份,一份中滴入氯气;另一份中滴加稀硫酸 | 两份溶液均变为红色 |
| 3.另取部分滤液于试管中,向其中加入浓NaOH溶液并加热,在试管口放置湿润的红色石蕊试纸. | 有气体生成,该气体使红色石蕊试纸变蓝. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当镀层都被破坏时,镀锌铁比镀锡铁更易被锈蚀 | |
| B. | 钢铁发生析氢腐蚀时和吸氧腐蚀时负极反应均是Fe-2e-=Fe2+ | |
| C. | 钢铁闸门上装上锌块是利用牺牲阳极的阴极保护法来防止其被腐蚀 | |
| D. | 钢管与电源负极连接是利用外加电流的阴极保护法来防止其被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com