
科目: 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙醇(水) | 新制的氧化钙 | 蒸馏 |
| D | 苯(甲苯) | 蒸馏水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
 +nCH2═
+nCH2═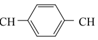 ═CH2$\stackrel{催化剂}{→}$
═CH2$\stackrel{催化剂}{→}$ +(2n-1)HI
+(2n-1)HI| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 通过质谱法测定PPV的平均相对分子质量,可得其聚合度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 聚乙烯制成的塑料可以反复加热熔融,是热塑性材料 | |
| B. | 用碱催化生成的酚醛树脂能形成网状结构,不溶于任何溶剂 | |
| C. | 在制备高吸水性树脂时要加入交联剂,以得到具有网状结构的树脂 | |
| D. | 天然纤维的主要成分都是纤维素 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 现象a,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
科目: 来源: 题型:解答题
| 成分 | Na+ | Mg2+ | Ca2+ | K+ | Li+ | Cl- | SO42- | Br- |
| 含量/mg•L-1 | 9965 | 1200 | 400 | 380 | 0.17 | 19350 | 1200 | 67 |
| 实验操作 | 实验现象 |
| Ⅰ.取1mL海水,加入1mL0.1mol/L的NaOH溶液 | 有白色沉淀 |
| Ⅱ.取1mLCaCl2溶液,加入1mL0.1mol/L的NaOH溶液 | 无白色沉淀 |


查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
| A. | a=1.64 | |
| B. | 此时正反应速率大于逆反应速率 | |
| C. | 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大 | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CuS的溶解度大于PbS的溶解度 | |
| B. | CuS既有氧化性又有还原性 | |
| C. | CuSO4与ZnS反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅:2NO2(g)?N2O4(g)△H<0 | |
| C. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| D. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在含大量Fe3+的溶液中:Na+、Cl-、SCN- | |
| B. | 在含大量Al3+的溶液中:Na+、HCO3-、Cl- | |
| C. | $\frac{\\;c(H+)}{c(OH-)}$=10-12溶液中:K+、AlO2-、CO32- | |
| D. | pH=0的溶液中:K+、I-、NO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com