
科目: 来源: 题型:选择题
| A. | 浅黄色沉淀可能是S | |
| B. | 溶液X中一定含有Fe3+ | |
| C. | 溶液X的溶质可能是FeBr2 | |
| D. | 如果浅黄色沉淀是AgI,则溶液X的溶质可能是FeI2或FeI3 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:推断题
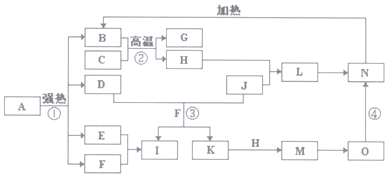
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲基的电子式: | B. | CH4分子的球棍模型: | ||
| C. | (CH3)2C=CH2的命名:1-甲基-2-丙烯 | D. | 甲醛的结构式: |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 溶液X中一定含有Iˉ、CO32ˉ、SO42ˉ | |
| B. | 通过在黄色溶液中加入硝酸银溶液可以检验溶液X中是否存在Cl- | |
| C. | 试剂①为硝酸钡溶液 | |
| D. | 通过焰色反应,可确认溶液X中阳离子的种类 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 实验操作 | 实验现象 | |
| A | 滴入淀粉溶液 | 溶液变蓝色 |
| B | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| C | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| D | 滴入KSCN溶液 | 溶液变红色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com