
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 选用试剂 | 实验现象 | |
| 第一种方法 | C | 有机层无色 |
| 第二种方法 | D | 溶液变红 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质$\stackrel{+O_{2}}{→}$ 氧化物 $\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐,能按照上述转化关系直接转化的可以是硫元素 | |
| B. | 某无色溶液中加入Ba(NO3)2溶液,再加入盐酸,沉淀不溶解,则原溶液中一定有SO42- | |
| C. | 浓硫酸有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题

 有机物B的名称为乙醛,结构简式为CH3CHO.
有机物B的名称为乙醛,结构简式为CH3CHO.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 试剂M 是HBr,加入HBr的目的是除去过量的Ca(OH)2 | |
| B. | 操作I为过滤,滤渣为Fe、Fe(OH)2和Fe(OH)3;操作Ⅱ为重结晶,具体操作步骤为蒸发浓缩、冷却结品、洗涤、干燥 | |
| C. | 制得的CaBr2•2H2O 可以通过以下方法测定纯度:称取一定量的样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,计算便得出CaBr2•2H2O的纯度 | |
| D. | 工业上也可以将氨气通入石灰乳,并加入溴,于65℃进行反应,制得溴化钙,此反应中还会生成一种无色气体,该反应的化学方程式为3Ca(OH)2+3Br2+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3CaBr2+N2+6H2O |
查看答案和解析>>
科目: 来源: 题型:解答题


 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr.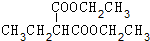 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中肯定有SO42-、Cu2+;一定没有Ba2+;其余离子不能确定 | |
| B. | 溶液中肯定有SO42-、Cu2+;可能有Na+、Cl- | |
| C. | 溶液中肯定有SO42-、Cu2+、Cl-;可能有Na+ | |
| D. | 溶液中如果同时有Na+和Cl-;则C(Na+)>C(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com