
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O
+3H2O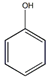 +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 吸收能量的反应 | B. | 放出能量的反应 | C. | 氧化还原反应 | D. | 可逆反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解质溶液为氢氧化钠溶液时负极发生的反应为H2+2OH--2e-═2H2O | |
| B. | 电解质溶液为硫酸溶液时正极发生的反应为O2+4e-+4H+═2H2O | |
| C. | 电解质溶液为氢氧化钠溶液时正极发生的反应为O2+2H2O+4e-═4OH- | |
| D. | 以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过,正极的电极反应为:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 如果m+n=p,则K=1 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度越高,K一定越大 | |
| D. | K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
查看答案和解析>>
科目: 来源: 题型:选择题
 ④CH3CH3.
④CH3CH3.| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H互为同位素 | B. | 金刚石和石墨互为同素异形体 | ||
| C. |  和 和  互为同分异构体 互为同分异构体 | D. | CH4和C2H6互为同系物 |
查看答案和解析>>
科目: 来源: 题型:解答题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com