
科目: 来源: 题型:选择题
| A. | 单质碘(I2) | B. | 碘化钠中化合态的碘(I-) | ||
| C. | 碘酸钠中的碘元素 | D. | 氯化碘(ICl)中的碘元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用电子天平称量硫酸铜晶体的质量为2.102克 | |
| B. | 标准盐酸溶液的物质的量浓度为 0.1摩尔/升 | |
| C. | 用10毫升规格的量筒量取7.2毫升的液体 | |
| D. | 用25毫升规格的滴定管量取7.20毫升的液体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:实验题
| 物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |

查看答案和解析>>
科目: 来源: 题型:实验题
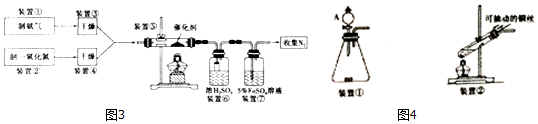
 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:实验题
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加32g.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加32g.据此回答问题:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com