
科目: 来源:2016-2017学年广东佛山一中高二上第一次段考化学卷(解析版) 题型:选择题
已知下列热化学方程式:
Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g);ΔH=-24.8kJ/mol
Fe2O3(s)+ CO(g)==
CO(g)== Fe3O4(s)+
Fe3O4(s)+ CO2(g);ΔH=-15.73kJ/mol
CO2(g);ΔH=-15.73kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g);ΔH=+640.4kJ/mol
则14 g CO气体还原 足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-218 kJ/mol B.-109 kJ/mol C.+218 kJ/mol D.+109 kJ/mol
查看答案和解析>>
科目: 来源:2016-2017学年广东佛山一中高二上第一次段考化学卷(解析版) 题型:选择题
一定温度下,将1 mol A和1 mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g) xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条 件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
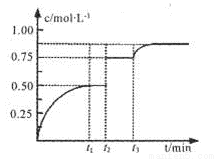
A.反应方程式中的x=1
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量物质C
D.t1~t3间该反应的平衡常数均为4
查看答案和解析>>
科目: 来源:2016-2017学年广东佛山一中高二上第一次段考化学卷(解析版) 题型:实验题
为探究测定中和热的实验,小明利用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3 kJ/mol)。
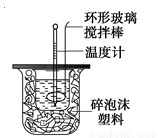
(1)写出实验所进行的中和反应的热化学方程式 。
(2)实验装置中,烧杯间填满碎纸条的作用为  。
。
(3)该实验中,使用浓度略大于盐酸的NaOH溶液的原因是 ,若改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1,NaOH溶液进行反应,所求中和热的数值_________(填“相等”或“不相等”),理由是 。
(4)小明利用上述装置做实验,测得中和热的数值偏低,请你分析可能的原因是 。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目: 来源:2016-2017学年广东佛山一中高二上第一次段考化学卷(解析版) 题型:简答题
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的碳层制得 :
:
C(s)+H2O(g) CO(g)+H2(g)△H=+131.3kJ•mol-1
CO(g)+H2(g)△H=+131.3kJ•mol-1
(1)该反应的化学平衡常数表达式K= ,若某温度下,K值的大小为0.5,此时向体积为1L的密闭容器中加入1mol H2O(g)和足量C(s),H2O(g)的平衡转化率为
(2)对于该反应,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气的浓度 c.加入催化剂 d.降低压强
(3)上述反应达到平衡后,移走体系中部分C(s),平衡 ,将产生的CO全部移走,平衡 (以上两空选填“向左移”、“向右移”、“不移动”)。
(4)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中 继续画出t1时刻之后正反应速率(ν正)随时间的变化:
继续画出t1时刻之后正反应速率(ν正)随时间的变化:
增大容器体积(用实线表示) ②升高温度(用虚线表示)
查看答案和解析>>
科目: 来源:2016-2017学年广东佛山一中高二上第一次段考化学卷(解析版) 题型:实验题
下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(已知:S2O32-+2H+ = H2O+S↓+SO2↑)
(1)除如图所示的实验用品、仪器外,还需要的一件实验仪器是__________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是 。
(3)试简述测定该反应的化学反应速率的其他方法: (写一种)。
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32- = S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4 )该实验进行的目的是 ,淀粉溶液的作用是 ,表中Vx= mL,通过比较t1、t2、t3大小,试推测该实验结论:
)该实验进行的目的是 ,淀粉溶液的作用是 ,表中Vx= mL,通过比较t1、t2、t3大小,试推测该实验结论: 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com