
科目: 来源:2017届黑龙江大庆一中高三上第二次月考化学试卷(解析版) 题型:选择题
下列化学反应先后顺序判断正确的是( )
A.在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I—、Br—、Fe2+
B.在含有等物质的量的OH—、CO32-、SO32-的溶液中加入稀盐酸:OH—、SO32-、CO32—
C.在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+
D.在含有等物质的量的H+、Al3+的溶液中,逐滴加入Na OH溶液:H+
OH溶液:H+ 、Al3+、Al(OH)3
、Al3+、Al(OH)3
查看答案和解析>>
科目: 来源:2017届黑龙江大庆一中高三上第二次月考化学试卷(解析版) 题型:选择题
下列有关溶液中离子的转化的表达合理的是( )
A.向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
B.用CH3COOH溶解CaCO3: CaCO3+2H+= Ca2++H2O+CO2↑
C.含有0.2molFeI2的溶液中加入0.25 molBr2: 2Fe2++4I-+3Br2=2Fe3++2I2+6Br-
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:
NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
查看答案和解析>>
科目: 来源:2017届黑龙江大庆一中高三上第二次月考化学试卷(解析版) 题型:选择题
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法正确的是 ( )
( )

A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.此装置用于铁表面镀铜时,a为铁b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相同
查看答案和解析>>
科目: 来源:2017届黑龙江大庆一中高三上第二次月考化学试卷(解析版) 题型:选择题
将17.9 g由Cu、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀HNO3中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入过量的NaOH溶液,则沉淀的质量为 ( )
A.22.1 g B.25.4 g C.33.2g D.无法计算
查看答案和解析>>
科目: 来源:2017届黑龙江大庆一中高三上第二次月考化学试卷(解析版) 题型:填空题
某强酸性溶液X含有Ba2+、Al3+、NH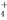 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO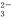 、SO
、SO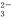 、SO
、SO 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
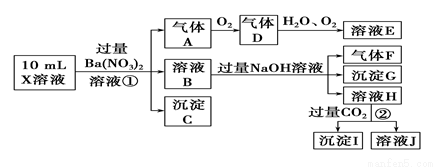
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是________________;肯定不存在的离子是 。
(2)写出有关离子方程式:步骤①中生成A___________________;步骤②生成沉淀I______________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶 液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是 。
液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是 。
查看答案和解析>>
科目: 来源:2017届黑龙江大庆一中高三上第二次月考化学试卷(解析版) 题型:填空题
工业上制取氯酸钾的主要步骤为:
I.将C12通入石灰浆,充分反应后过滤;
II.向滤液中加入稍过量的KCl固体,进行适当操作可析出KClO3固体。
请回答下列问题:
步骤I存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,总反应的化学方程式为6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 。
(1)①标出反应6Ca(OH)2+ 6Cl2=Ca(ClO3)2+5CaCl2+ 6H2O 中电子转移的方向和数目
② 滤液中Ca(ClO3)2与CaC12的物质的量之比n[Ca(ClO3)2]:n [CaCl2]___________l:5(填“>”、“<”或“=”),理由是___________ 。(请用有关反应和必要的文字进行说明)

(2)上图是有关物质的溶解度曲线. 步骤II中,若溶液中KClO3的含量为100g·L-1,从该 溶液中尽可能多地析出KClO3 固体的方法是______________。
溶液中尽可能多地析出KClO3 固体的方法是______________。
查看答案和解析>>
科目: 来源:2017届黑龙江大庆一中高三上第二次月考化学试卷(解析版) 题型:填空题
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g) 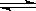 CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)每消耗8g CH4转移的电子的数目为 。
(2)已知:①2CO(g)+O2(g)=2CO2(g) △H1=akJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=ckJ·mol-1
④CH4(g)+H2O(g)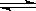 CO(g)+3H2(g) △H4
CO(g)+3H2(g) △H4
由此计算△H4= kJ·mol-1。
(3)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g) 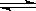 CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时,c(CH4)=0.5mol·L-1。
①0~tmin内,该反应的平均反应速率v(H2) = 。②T℃时,该反应的平衡常数K= 。
= 。②T℃时,该反应的平衡常数K= 。
③当温度升高到(T+100)℃时,容器中c(CO)=0.75 mol·L-1,则该反应是 反应(填“吸热”或“放热”)。
(4)已知熔融碳酸盐燃料电池的工作原理示意图如下:

①放电过程中K+和Na+向电极 (填“A”或“B”)移动。
②该电池的负极反应式为 。
查看答案和解析>>
科目: 来源:2017届山西省高三上10月阶段测化学卷(解析版) 题型:选择题
下列物质按纯净物、混合物、强弱电解质和非电解质顺序排列的是
A.单甘油酯、混甘油酯、苛性钾、H2S、三氧化硫
B.胆矾、漂白粉、硫酸钠、次氯酸、氯气
C.明矾、水煤气、盐酸、醋酸、铜
D.冰醋酸、福尔马林、硫酸钡、H2S、乙醇
查看答案和解析>>
科目: 来源:2017届山西省高三上10月阶段测化学卷(解析版) 题型:选择题
下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低 B.次氯酸和双氧水使品红试液褪色
C.氯水和水玻璃长期暴露在空气中变质 D.苯和乙烯使溴水褪色
查看答案和解析>>
科目: 来源:2017届山西省高三上10月阶段测化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.78g 苯含有C=C双键的数目为3NA
B.1L 1mol·L -1的Na2CO3溶液中含有阴离子的数目大于NA
C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为2NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com