
科目: 来源: 题型:解答题
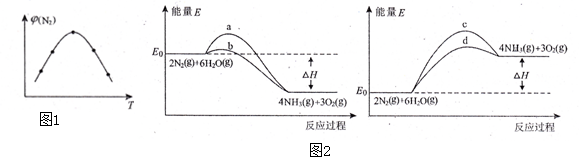
查看答案和解析>>
科目: 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率x(Z)=2.0×10-3mol•L-1min-1 | |
| B. | 其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少 | |
| C. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| D. | 保持其他条件不变,起始时向溶液中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol |
查看答案和解析>>
科目: 来源: 题型:解答题
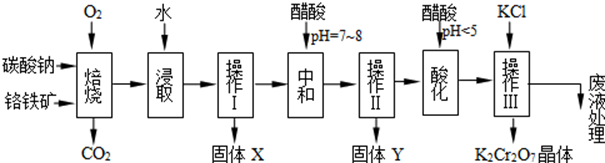
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目: 来源: 题型:填空题
| 物质 | A | NaCl | KCl | CaCl2 |
| 熔点(K) | 1074 | 918 | ||
| 物质 | B | Na | Mg | Al |
| 熔点(K) | 317 | 923 | 933 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
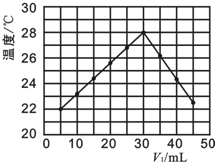 酸碱中和滴定是中学化学中重要的定量实验之一.
酸碱中和滴定是中学化学中重要的定量实验之一.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
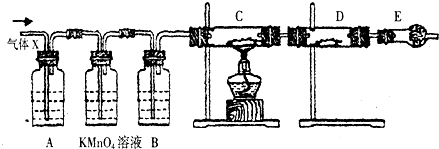
查看答案和解析>>
科目: 来源: 题型:填空题
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com