
科目: 来源: 题型:选择题
| A | B | C | D | |
| 改变的条件 | 压强 | 温度 | 平衡体系增加H2 | 催化剂 |
| 变化的示意图 |  | 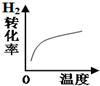 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的电子式: | |
| B. | Cl原子的结构示意图: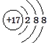 | |
| C. | 质子数为53,中子数为78的碘原子的核素符号:${\;}_{53}^{131}$I | |
| D. | 2,3-二甲基-2-丁烯的结构简式: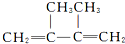 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| D. | 纯净的二氧化硅是现代光学及光纤制品的基本原料 |
查看答案和解析>>
科目: 来源: 题型:解答题
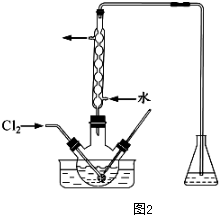
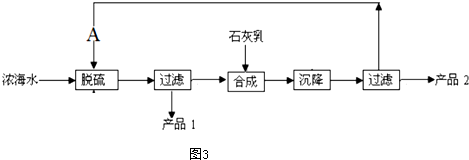
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g.l-2) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| X | |||
| Y | Z |
| A. | X和Y都是非金属元素,其中X最高化合价为+5 | |
| B. | X、W的最高价氧化物在一定条件下能反应 | |
| C. | 元素X、W和氧元素可形成化学式为W2XO3,离子化合物 | |
| D. | Y、Z的氢化物的稳定性Y<2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| B. | 10mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 0.1mol•L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  表示某吸热反应分别在有、无催化剂的情兄下反应过程中的能量变化 | |
| B. | 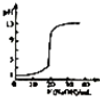 表示常温下,0.1 OOOmoi/LNaOH 溶液液滴定 20.00mL、0.0100/LHCl 溶液 所得到的滴定曲线 | |
| C. | 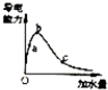 表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c>a>b | |
| D. | 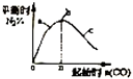 表示反应4CO+2NO2(g)?N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体识分数变化情况,由图可知NO2的转化率 c>b>a |
查看答案和解析>>
科目: 来源: 题型:解答题
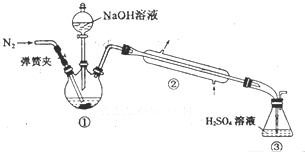 某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO过量 | B. | CO与铁矿石接触不充分 | ||
| C. | 炼铁高炉的高度不够 | D. | CO与Fe2O3的反应有一定限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com