
科目: 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A. | Z的氧化物对应的水化物一定是一种强酸 | |
| B. | 原子半径大小顺序是X>Y>Z | |
| C. | Y的单质比Z的单质更易与氢气反应 | |
| D. | Z的单质与Fe反应形成的化合物中,铁元素显+3价 |
查看答案和解析>>
科目: 来源: 题型:选择题
 用电解法制备无机高分子聚合物--聚合氯化铝.如图所示,在一定条件下进行,电解总反
用电解法制备无机高分子聚合物--聚合氯化铝.如图所示,在一定条件下进行,电解总反| A. | Cu电极与电源正极相连 | |
| B. | 聚合氯化铝化学式中x=4 | |
| C. | 电解时阴极的电极反应式为:2H++2e?═H2↑ | |
| D. | 将电源换成导线连接两电极,则不能形成原电池 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | B. | c(Na+)=2c(HS-)+2c(S2-)+c(H2S) | ||
| C. | c(Na+)>c(OH-)>c(HS-)>c(H+) | D. | c(H2S)+c(HS-)+c(H+)=c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标有“ ”的包装材料可以用来包装食品 ”的包装材料可以用来包装食品 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | GaN中的氮和镓均属于第IIIA族元素 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 三聚氰胺(分子式:C3H6N6)含氮量很高,可作为牛奶添加剂 | |
| B. | 聚氯乙烯能使溴的四氯化碳溶液褪色 | |
| C. | 为了减少“白色污染”,我国规定商家不得提供塑料袋 | |
| D. | 低碳生活就是节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放 |
查看答案和解析>>
科目: 来源: 题型:解答题
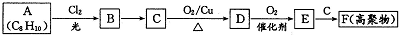
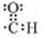 ;E一→F反应类型为缩聚反应.
;E一→F反应类型为缩聚反应. .
.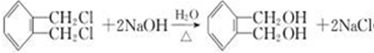 .
.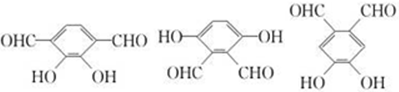 (2种即可).
(2种即可).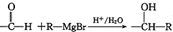 现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J(
现发生反应D+G$\stackrel{H+/H_{2}O}{→}$H$→_{△}^{浓H_{2}SO_{4}}$J( ),则
),则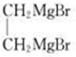 ,
,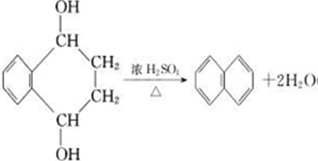 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向①中逐滴加入少量②,$\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$逐渐增大 | |
| B. | ①、③等体积混合后溶液中存在:NH4++H2O?NH3•H2O+H+ | |
| C. | ①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+) | |
| D. | ①、③按体积比2:1混合:c(NH4+)>c(NH3•H2O)>c(SO42-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 玻璃、陶瓷、水泥、光导纤维的化学组成都是硅酸盐 | |
| B. | 污水处理中的化学方法有混凝法、中和法、沉淀法、氧化还原法等 | |
| C. | 对不可回收垃圾常用的处理方法有卫生填埋、堆肥和焚烧 | |
| D. | 固体煤经处理变为气体燃料后,可以减少SO2和烟尘的污染,且燃烧效率高 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com