
科目: 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| A | NO2 | SO2 | BaCl2 |
| B | HCl | CO2 | 澄清石灰水 |
| C | CO2 | SO2 | 澄清石灰水 |
| D | CO2 | CO | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O2 | B. | FeCl3 | C. | O2 | D. | FeCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HCl>HBr>HI | B. | 离子半径:S2->Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 熔点:SiO2>NaCl>干冰 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 空气 SO2、NO、NO2、CO | |
| B. | 碱性溶液 Na+、K+、NO3-、CO32- | |
| C. | 酸性溶液 Na+、ClO-、SO42-、SiO32- | |
| D. | KNO3溶液 Fe2+、H+、Cl-、Cu2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 步骤①的化学方程式为:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| B. | 步骤①②③中每生成或反应1mol Si,转移4mol电子 | |
| C. | 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应 | |
| D. | SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用氨水吸收过量的二氧化硫:NH3•H2O+SO2=NH4++HSO3- | |
| B. | 在澄清石灰水中通入少量二氧化碳:OH-+CO2=HCO3- | |
| C. | 向溴化亚铁中通入少量氯气:2Br-+Cl2=2Cl-+Br2 | |
| D. | 用氢氧化钠吸收多余的氯气:OH-+Cl2=2Cl-+HClO |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目: 来源: 题型:解答题
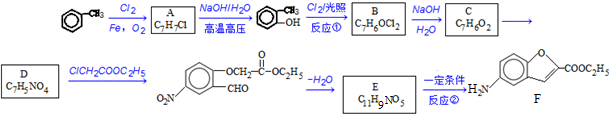
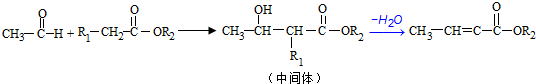
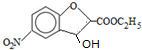 ;反应①的反应类型为取代反应;
;反应①的反应类型为取代反应;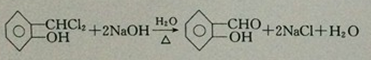 ;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为
;ClCH2COOC2H2加热条件下与足量NaOH反应后酸化所得有机物,发生聚合反应的化学方程式为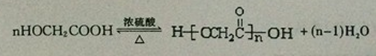 ;
;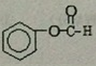 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
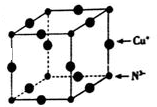 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com