
科目: 来源: 题型:解答题
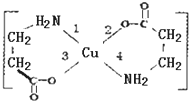 II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:
II.二甘氨酸合铜(II)是最早被发现的电中性内配盐,它的结构如图:查看答案和解析>>
科目: 来源: 题型:解答题
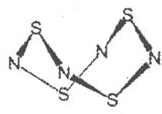
查看答案和解析>>
科目: 来源: 题型:解答题
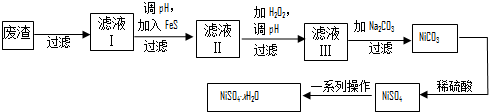
查看答案和解析>>
科目: 来源: 题型:填空题
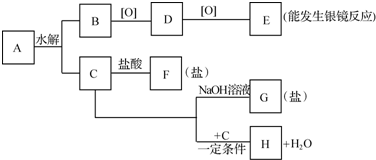
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
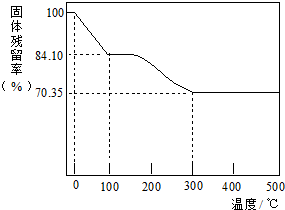
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| B. | pH相等的①CH3COONa、②C6H5ONa、③Na2CO3、④NaOH四种溶液的物质的量浓度大小:①>②>③>④ | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 向0.1 mol•L-1 NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 氨水加水稀释后,溶液中c (NH3•H2O)/c (NH4+)的值减小,c (H+)增大 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| C. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次增强 | |
| D. | 加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com