
科目: 来源: 题型:解答题
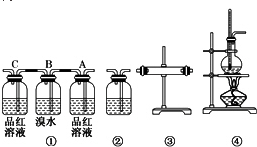
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | ${\;}_{\;}^{37}$Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 35克的${\;}_{\;}^{35}$Cl2含有电子17mol | |
| D. | 常温下,4.48L ${\;}_{\;}^{37}$Cl2含有8NA 个中子(NA 为阿伏加德罗常数) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
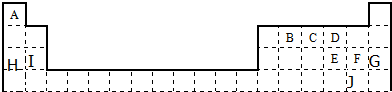
 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系.
A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素,其中A中含有5个原子核,它们之间有如下的反应关系. 、D
、D .
.查看答案和解析>>
科目: 来源: 题型:解答题
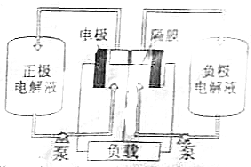 偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.
偏钒酸铵(NH4VO3)为白色或微黄色的晶体粉末,微溶于水和氨水,而难溶于冷水,在钒的湿法冶金中占重要地位.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com