
科目: 来源: 题型:解答题
 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛. .新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)
.新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)查看答案和解析>>
科目: 来源: 题型:选择题
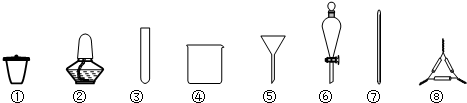
| A. | 海带灼烧灰化,选用①②⑧ | B. | 加水浸泡加热,选用②④⑦ | ||
| C. | 过滤得到滤液,选用④⑤⑦ | D. | 萃取和分液,选用③④⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
查看答案和解析>>
科目: 来源: 题型:解答题
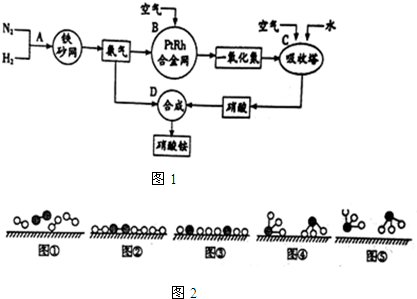
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目: 来源: 题型:解答题
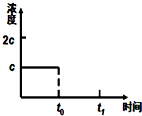 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( ) | 金属 | 电子流动方向 | 电压(V) |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | E→Cu | +0.30 |
| A. | 金属乙能从硫酸铜溶液中置换出铜 | |
| B. | 甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀 | |
| C. | 在四种金属中乙的还原性最强 | |
| D. | 甲、丁若形成原电池时,甲为正极 |
查看答案和解析>>
科目: 来源: 题型:多选题
 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol(L•min) | |
| B. | 该温度下此反应的平衡常数K=$\frac{0.32}{{t}_{2}}$ | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.10 mol气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
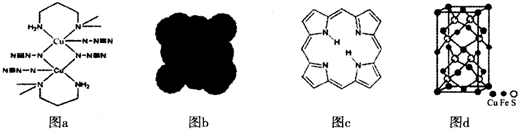
查看答案和解析>>
科目: 来源: 题型:解答题
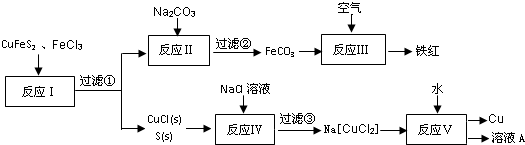
查看答案和解析>>
科目: 来源: 题型:解答题
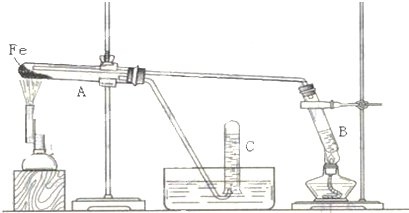
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com