
科目: 来源: 题型:选择题
| A. | 35.5:108 | B. | 1:8 | C. | 108:35.5 | D. | 137:71 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 除去MgCl2溶液中的Fe3+,可向溶液中加入氨水调节pH | |
| B. | 除去污水中的金属离子Cu2+、Hg2+,可向溶液中加入FeS | |
| C. | 除去Cl2中混有的HCl,可以将气体通入饱和氯化钠溶液 | |
| D. | 除去CaCO3中的少量CaSO4,可以向其中加入足量饱和Na2CO3溶液后过滤 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  表示稀释冰醋酸过程中溶液导电性的变化曲线 | |
| B. |  曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 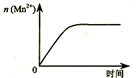 表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 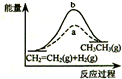 a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 均减半 | B. | 均加半 | C. | 均增加1mol | D. | 均减少1mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | 相同浓度和体积的强酸与强碱溶液混合后,溶液的PH=7 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 若反应2A(g)+B(g)=2C(g)在一定条件下是一个自发的反应,则该反应为吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | +244.1 kJ•mol-1 | B. | -488.3 kJ•mol-1 | C. | -996.6 kJ•mol-1 | D. | +996.6 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目: 来源: 题型:选择题
 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$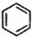 (g)+3H2(g)△H>0,若该反应在恒容的密闭容器中进行,下列有关该反应的图象判断正确的是( )
(g)+3H2(g)△H>0,若该反应在恒容的密闭容器中进行,下列有关该反应的图象判断正确的是( )| A. |  | B. | 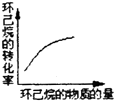 | C. | 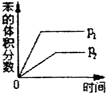 | D. |  |
查看答案和解析>>
科目: 来源: 题型:解答题
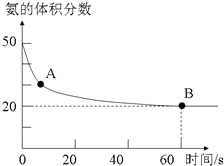 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
氨气是一种重要的化工原料,在工农业中都有广泛的应用.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com