
科目: 来源: 题型:选择题
| A. | H、N、Na、Fe、V五种元素中,有两种是第四周期元素 | |
| B. | 铁元素位于周期表中的第四周期,第8纵行,属于第ⅧA族 | |
| C. | 第四、五、六、七周期,每周期的元素共有18种 | |
| D. | 碱金属元素是指第ⅠA族的所有元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 117号元素位于第七周期第ⅦB族 | B. | 117号元素是一种金属元素 | ||
| C. | 117号元素最外层有5个电子 | D. | 117号元素没有正化合价 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | SO42-、SO32-至少含有一种 | |
| B. | 沉淀B的化学式为BaCO3 | |
| C. | 肯定存在的阴离子有CO32-、HCO3-、Cl-,还有SO42-、SO32-至少含有一种 | |
| D. | 肯定没有的离子是Br- |
查看答案和解析>>
科目: 来源: 题型:解答题
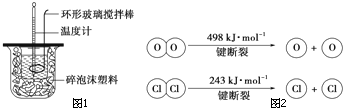 针对化学反应中的能量变化解决下列问题.
针对化学反应中的能量变化解决下列问题.查看答案和解析>>
科目: 来源: 题型:解答题
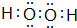 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H1 | B. | S(s)+3/2O2(g)=SO3(s)△H2 | ||
| C. | CH4(g)+2O2(g)=2H2O(l)+CO(g)△H3 | D. | 2CO(g)+O2(g)=CO2(g)△H4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有的化学反应都有能量变化 | |
| B. | 只要有能量的变化,一定发生了化学反应 | |
| C. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 | |
| D. | 需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
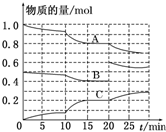 在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度T℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 钠的化合物在生产生活中应用广泛.
钠的化合物在生产生活中应用广泛.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com