
科目: 来源: 题型:解答题
 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空: .
.查看答案和解析>>
科目: 来源: 题型:解答题
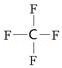
 ,1molO22+中含有的π键数目为2NA.
,1molO22+中含有的π键数目为2NA.查看答案和解析>>
科目: 来源: 题型:选择题
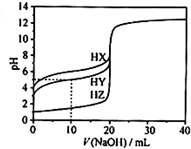 25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法不正确的是( )
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法不正确的是( )| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | HY与HZ混合,达到平衡时:c(H+)=$\frac{{k}_{2}(HY)•c(HY)}{c({Y}^{-})}$+c(Z-)+c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该温度下,Ksp (BaSO4 )=1.0×10-24 | |
| B. | a点的Ksp (BaSO4 )小于b点的Ksp (BaSO4 ) | |
| C. | d点表示的是该温度下BaSO4的不饱和溶液 | |
| D. | 加入BaCl2可以使溶液由 c点变到a点 |
查看答案和解析>>
科目: 来源: 题型:选择题
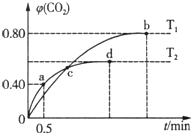 利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )
利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)?5CO2(g)+I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4mol CO,测得CO2的体积分数随时间t变化曲线如图.下列说法不正确的是( )| A. | T2时,0~0.5 min内的反应速率v(CO)=1.6mol/(L•min) | |
| B. | 两种温度下,c点时体系中混合气体的压强相等 | |
| C. | d点时,增大体系压强,CO的转化率不变 | |
| D. | b点和d点时化学平衡常数的大小关系:Kb>Kd |
查看答案和解析>>
科目: 来源: 题型:解答题
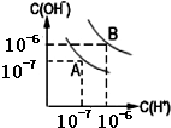 (1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 弱碱 | B. | 一元强碱 | C. | 多元强碱 | D. | 任何强碱 |
查看答案和解析>>
科目: 来源: 题型:解答题
| m | n | ||
| x | y |
 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 与E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol O2与Na完全反应,转移电子数一定为4NA | |
| B. | 常温常压下,1.7克NH3中含有共价键的数目为NA | |
| C. | 142g Na2SO4和Na2HPO4混合物中含有的阴、阳离子总数是3 NA | |
| D. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com