
科目: 来源: 题型:选择题

| A. | △H1<△H2 | |
| B. | 若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温常下能自发进行 | |
| C. | CO32-(aq)+2H+(aq)=CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol | |
| D. | 相同条件下,结合H+的能力:CO32->HCO3- |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:3 | B. | 2:5 | C. | 1:2 | D. | 1:3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
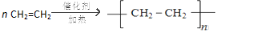 .
.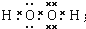 ;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.
;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式. .与PH3相比,DC2易液化的主要原因是NH3中有氢键;
.与PH3相比,DC2易液化的主要原因是NH3中有氢键;查看答案和解析>>
科目: 来源: 题型:解答题
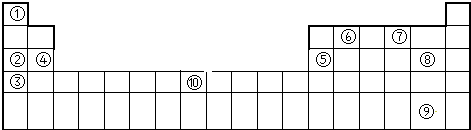
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Hm+2bXOb | B. | Hm-2bXOb | C. | Hb+mXOb | D. | H2b-mXOb |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素周期表中元素种类最多的周期是第6周期 | |
| B. | 第IA族元素均为碱金属元素 | |
| C. | 原子最外层电子数为2的元素一定位于第ⅡA族 | |
| D. | 元素周期表中元素种类最多的族是第Ⅷ族 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2:3:6 | B. | 3:2:1 | C. | 4:3:1 | D. | 6:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com