
科目: 来源: 题型:解答题
| 阳离子 | K+ Na+ NH+4 Fe2+ Ba2+ Cu2+ |
| 阴离子 | OH- I- NO3- AlO2- HCO3- HSO4- |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,G在元素周期表中的位置为第三周期第ⅤⅡA族.
,G在元素周期表中的位置为第三周期第ⅤⅡA族.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 按系统命名法,有机物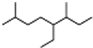 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 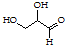 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原反应 | |
| C. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次增加 | |
| D. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子的单体是1,3-丁二烯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去,证明生成的气体全部是乙烯 | |
| B. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| C. | 某些强氧化剂如氯酸钾、硝酸钾等或其混合物不能研磨,否则可能引起爆炸 | |
| D. | 取5mL0.1mol•L-1KI溶液,滴加0.1mol•L-1FeCl3溶液5~6滴,继续加入2mLCCl4,充分振荡后静置,取上层溶液加KSCN溶液,无明显现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 126C、136C、146C为碳元素的三种核素.元素周期表中碳的相对原子质量为12.01,说明自然界中的碳主要以126C的核素形式存在 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,加快该反应的速率,却不能提高该反应的平衡转化率 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 | |
| D. | 绿色荧光蛋白在研究癌症发病机制的过程中应用突出,但其在酸性或碱性条件下可能会失去发光功能 |
查看答案和解析>>
科目: 来源: 题型:解答题
 写出B的化学式Fe2O3
写出B的化学式Fe2O3查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 至少含有4种离子 | |
| B. | 取少量原溶液先加入盐酸,后加入BaCl2溶液,肯定会产生白色沉淀 | |
| C. | 若原溶液中加入硝酸酸化的硝酸银溶液产生白色沉淀,则可推断溶液中含有K+ | |
| D. | 溶液中可能含有Fe3+、NH4+、SO42-、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl-?[CoCl4]2-(蓝色)+6H2O△H=akJ•mol-1,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:a<0 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体-半透膜法分离提纯;悬浊液-过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子” |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PM2.5表示每立方米空气中直径小于或等于2.5μm的颗粒物的含量,PM2.5值越高,大气污染越严重,因此由PM2.5引起的雾霾一定属于胶体 | |
| B. | 分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 | |
| C. | 对“地沟油”加工处理可以达到变废为宝的目的,比如对“地沟油”进行分馏可以制得汽油、煤油 | |
| D. | 次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌.自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com