
科目: 来源: 题型:解答题
 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: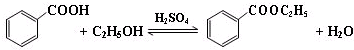
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
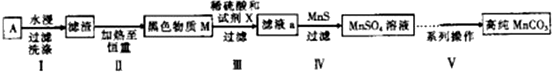
| 实验编号 | 试剂X | MnSO4/g |
| 1 | 锌粉 | 2.3595 |
| 2 | 铁粉 | 2.7184 |
| 3 | 硫化亚铁 | 2.9911 |
| 4 | 30%过氧化氢 | 3.7349 |
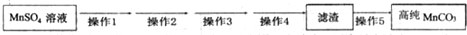
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

| 物质 | 性质(沸点及分解温度均为101kPa测得) |
| 邻苯二甲酸酐 (M=148g/mol) | 白色针状晶体.不溶于冷水,溶于热水及有机溶剂. 密度1.53g/cm3,沸点295℃. |
| 正丁醇(M=74g/mol) | 无色液体.微溶于水,溶于有机溶剂.密度0.81g/cm3,沸点117.7℃.可与水形成二元共沸物(沸点92.7℃). |
| 邻苯二甲酸二丁酯 (M=278g/mol) | 无色油状液体.难溶于水,溶于有机溶剂.密度1.49g/cm3,沸点340℃.酸性条件下180℃以上易发生分解. |
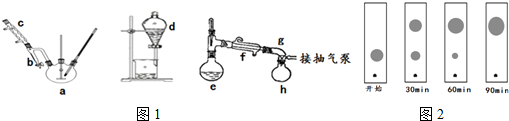
 转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.
转变成盐,从而与产物分离,该操作是否可改用NaOH溶液?否(填“是”或“否”),原因是;氢氧化钠碱性太强,能使邻苯二甲酸二丁酯发生水解;.加入食盐水洗涤一方面是防止有机物发生乳化而不利于分层,另一方面是为了降低邻苯二甲酸二丁酯的溶解度.查看答案和解析>>
科目: 来源: 题型:解答题
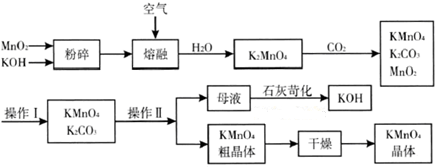
查看答案和解析>>
科目: 来源: 题型:解答题
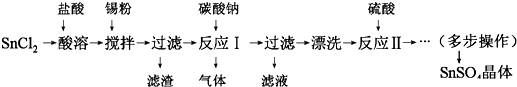
 无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):
无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):查看答案和解析>>
科目: 来源: 题型:填空题
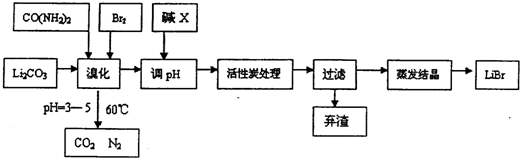
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com