
科目: 来源: 题型:选择题
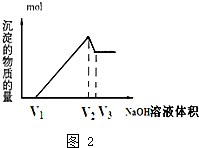
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中Cl-与SO42-之比为( )| A. | 2:3 | B. | 1:3 | C. | 3:2 | D. | 2:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
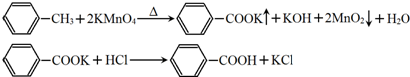
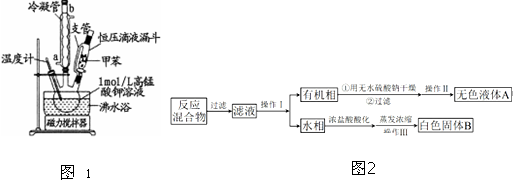
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解,冷却结晶、过滤. | 得到白色晶体和无色溶液 | ╲ |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液. | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点. | 白色晶体在122.4℃左右时完全熔化 | 白色晶体是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有在生物体内才能合成的物质 | B. | 有机物都是含有碳元素的化合物 | ||
| C. | 有机化合物都能燃烧 | D. | 含有碳元素的物质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
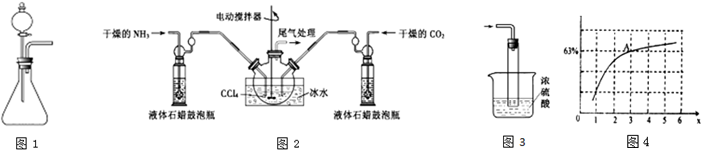
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
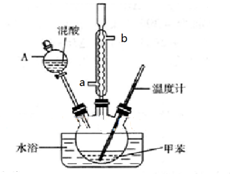
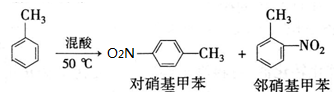
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液体烃 |

查看答案和解析>>
科目: 来源: 题型:解答题
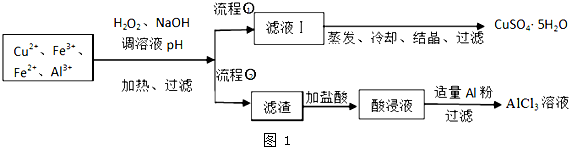
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com