
科目: 来源: 题型:选择题
| A. | 86 | B. | 136 | C. | 50 | D. | 222 |
查看答案和解析>>
科目: 来源: 题型:解答题
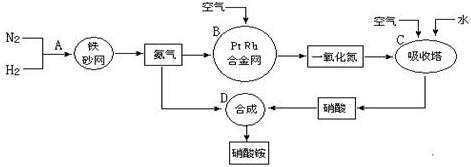
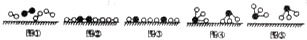
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | 只有②③④ | C. | ②③④⑤ | D. | 全部都行 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 卤素单质的最外层电子数都是7 | |
| B. | 从上到下,卤素原子的电子层数依次增多,半径依次减小 | |
| C. | 卤素单质与H2化合的容易程度为F2<Cl2<Br2<I2 | |
| D. | 从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,元素的非金属性依次减弱 |
查看答案和解析>>
科目: 来源: 题型:填空题
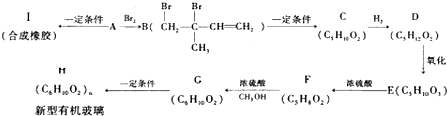
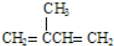 (不考虑立体异构),由G生成H的反应类型是加聚反应;
(不考虑立体异构),由G生成H的反应类型是加聚反应;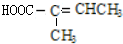 +CH3OH$→_{△}^{浓硫酸}$
+CH3OH$→_{△}^{浓硫酸}$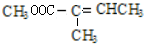 +H2O.与F具有相同官能团且比F少一个碳原子的有机物的同分异构体有3种(不考虑立体异构);
+H2O.与F具有相同官能团且比F少一个碳原子的有机物的同分异构体有3种(不考虑立体异构);查看答案和解析>>
科目: 来源: 题型:填空题
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| C | 有两种同素异形体,其中一种可吸附对人体有害的短波紫外线,防止其到达地球表面 |
| D | 价电子排布为(n+1)s+(n+1)p(n+2) |
| E | 苯酚遇其某种价态的离子显紫色 |
查看答案和解析>>
科目: 来源: 题型:选择题
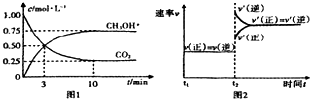
| A. | 平衡时该反应的平衡常数=$\frac{16}{3}(mol/L)^{-2}$ | |
| B. | 平衡时CO2的转化率为50% | |
| C. | t2时刻改变的条件是高温度 | |
| D. | 在0-3min时H2的反应速率为0.5mol•(L•min)-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
 今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )
今年两会的一个主题是环境保护,治理雾霾天气是我们目前最主要的一个任务.如图是北京统计的雾霾天气的来源和成分分析:下列对于治理雾霾天气措施描述不正确的是( )| A. | 充分的洗涤燃煤,除去燃煤表面的灰尘 | |
| B. | 加快我国由“燃煤”时代进入到“油气”时代的步伐 | |
| C. | 采用催化转换技术将汽车尾气中的NO2和CO转化为无毒气体 | |
| D. | 处理NO2的一种方法是利用甲烷催化还原NO2,若CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-512kJ•mol-1,则1g甲烷处理NO2需要放出16kJ的热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
 可简化为:
可简化为: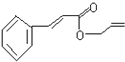 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: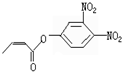 ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )| A. | 遇FeCl3溶液均显紫色 | B. | 均能发生氧化反应 | ||
| C. | 均能与溴水发生反应 | D. | 均能与NaOH溶液发生反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com