
科目: 来源: 题型:解答题
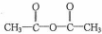 .
.
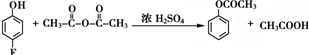 ;反应⑤的化学方程式为
;反应⑤的化学方程式为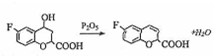 .
.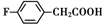 、
、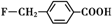 .
. 和乙酸酐为原料制备
和乙酸酐为原料制备 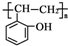 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目: 来源: 题型:解答题
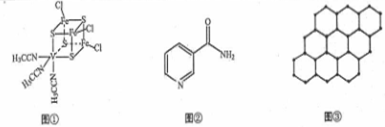
 .
.
查看答案和解析>>
科目: 来源: 题型:解答题
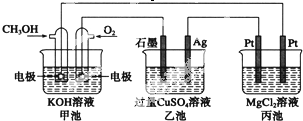
查看答案和解析>>
科目: 来源: 题型:解答题
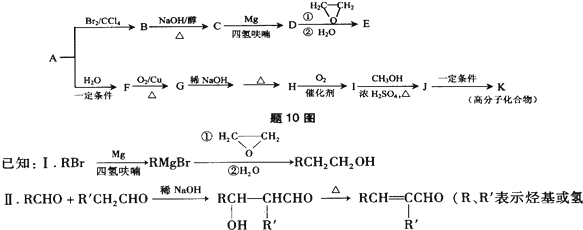
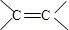 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
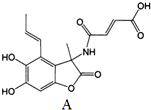
| A. | 化合物M的分子式为C16H15NO7 | |
| B. | 1 mol M在NaOH溶液中反应,最多消耗4 mol NaOH | |
| C. | 化合物M能发生加成反应,不能发生消去反应 | |
| D. | 化合物M能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目: 来源: 题型:解答题
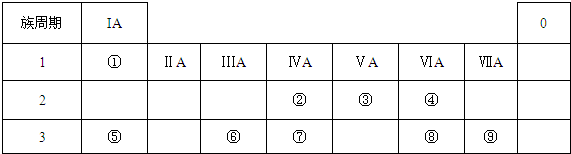

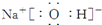 或
或 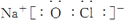 .
.查看答案和解析>>
科目: 来源: 题型:解答题
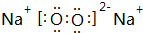 .
. ,空间构型直线型,属于非极性分子(填“极性”或“非极性”)
,空间构型直线型,属于非极性分子(填“极性”或“非极性”)查看答案和解析>>
科目: 来源: 题型:解答题
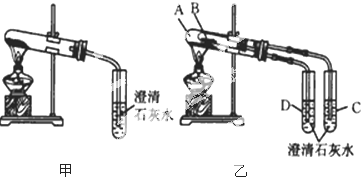
查看答案和解析>>
科目: 来源: 题型:解答题
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
 ,丁的结构式
,丁的结构式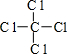
 ,最高价氧化物的水化物化学式为HClO4.
,最高价氧化物的水化物化学式为HClO4.查看答案和解析>>
科目: 来源: 题型:解答题
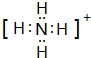 ,B-的化学式为OH-.
,B-的化学式为OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com