
科目: 来源: 题型:选择题
| A. | 少量铁粉加入AgNO3溶液中 | |
| B. | 少量Na2O2粉末加入CuSO4溶液中 | |
| C. | 少量BaSO4粉末加入饱和Na2CO3溶液中 | |
| D. | 少量Al2(SO4)3粉末加入Ba(OH)2溶液中 |
查看答案和解析>>
科目: 来源: 题型:解答题

 ;
;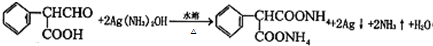 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某单质在常温下跟水反应不如钠剧烈 | |
| B. | 某碳酸盐易溶于水 | |
| C. | 其原子半径比钾原子半径小 | |
| D. | 某氢氧化物不能使Al(OH)3溶解 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | A | B | C | D |
| 剩余固体 | Cu(NO3)2、CuO | Cu2O、CuO | Cu2O、CuO | Cu(NO3)2、Cu2O |
| 剩余气体 | 无气体剩余 | 氧气2.5×10-3mol | NO 2.5×10-3mol | 氧气2.5×10-3mol |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com