
科目: 来源: 题型:选择题
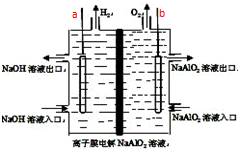 工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )
工业上利用离子膜电解偏铝酸钠溶液制备高品质的氢氧化铝,装置如图所示(a、b为电源的电极),有关说法正确的是( )| A. | 当有0.1mol 电子发生转移时,a极产生气体在标准状况下为112mL | |
| B. | 该电池使用时应选择阴离子交换膜 | |
| C. | 电池工作结束后,左右两侧电解槽均会有Al(OH)3沉淀生成 | |
| D. | 该电池的总反应方程式为:4NaAlO2+10H2O$\frac{\underline{\;通电\;}}{\;}$ 4Al(OH)3↓+4NaOH+O2↑+2H2↑ |
查看答案和解析>>
科目: 来源: 题型:解答题
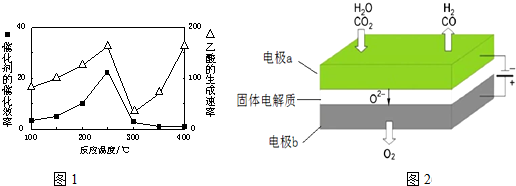
查看答案和解析>>
科目: 来源: 题型:解答题
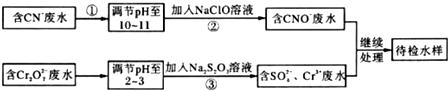
查看答案和解析>>
科目: 来源: 题型:解答题
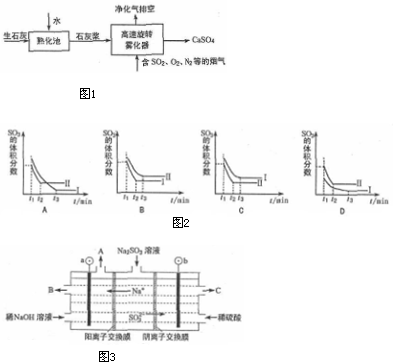
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠 | 偏向Mg |
| 5 | Al、Zn | 稀盐酸 | 偏向Al |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同周期主族元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中零族元素的单质常温常压下全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大就越容易得电子 | |
| D. | 非金属元素的最低负价都和它的族序数相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Fe | C | Cu | Zn |
| 负极 | Cu | Fe | Fe | Fe |
| 电解质溶液 | CuSO4 | H2SO4 | CuCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com