
科目: 来源: 题型:多选题
| A. | 取溴代烃少许,加入AgNO3溶液 | |
| B. | 取溴代烃少许与NaOH水溶液共热,然后加入AgNO3溶液 | |
| C. | 取溴代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 | |
| D. | 取溴代烃少许与NaOH水溶液共热后,加入稀硝酸酸化后,再加入AgNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
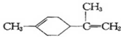 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 柠檬烯的一氯代物有9种 | |
| B. | 柠檬烯和丁基苯(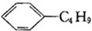 )互为同分异构体 )互为同分异构体 | |
| C. | 柠檬烯的分子中所有的碳原子可能在同一个平面上 | |
| D. | 一定条件下,柠檬烯可以发生加成、取代、氧化等反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
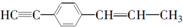 的说法中正确的是( )
的说法中正确的是( )| A. | 有7个碳原子可能在同一直线上 | |
| B. | 只可能有5个碳原子在同一直线上 | |
| C. | 最多只可能有9个碳原子在同一平面上 | |
| D. | 所有原子都可能在同一平面上 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| t/min | 1 | 4 | 8 | 11 |
| n(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 该温度下,平衡常数K=0.5 | |
| B. | 反应进行4min时,V(C02)=0.45 mol/(L•min) | |
| C. | 反应进行到9min时,H2的转化率比8min时高 | |
| D. | 反应进行11min后,若增大容器内压强,CO2的转化率一定增大 |
查看答案和解析>>
科目: 来源: 题型:填空题
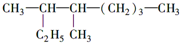 的名称是3,4一二甲基辛烷,
的名称是3,4一二甲基辛烷, ,1mol该烃完全燃烧需消耗氧气18.5mol,
,1mol该烃完全燃烧需消耗氧气18.5mol,查看答案和解析>>
科目: 来源: 题型:解答题
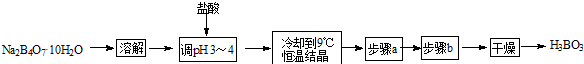


查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
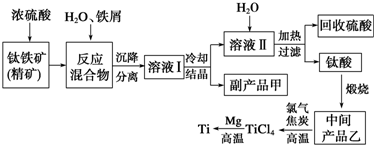
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com