
科目: 来源: 题型:解答题
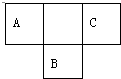 短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空: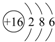
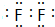 ,C的单质溶于水所得溶液叫:氢氟酸.
,C的单质溶于水所得溶液叫:氢氟酸.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放热反应的反应物总能量,高于生成物的总能量 | |
| B. | 需加热或点燃才发生的反应必为吸热反应 | |
| C. | 酸与碱的中和反应是放热反应 | |
| D. | 焦炭在高温下与水蒸气的反应是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第二周期元素从C到F,非金属性逐渐减弱 | |
| B. | 第三周期元素从Na到Cl,原子半径逐渐增大 | |
| C. | HF、HCl、HBr、HI的热稳定性依次逐渐增强 | |
| D. | LiOH、NaOH、KOH的碱性依次逐渐增强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 煤经过分馏可得到焦炉气、煤焦油和焦炭 | |
| B. | 甲烷、汽油、酒精都是碳氢化合物,都可作燃料 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 蛋白质、淀粉、油脂均能发生水解反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
| 化学键 | A-A | C≡C | A-C |
| 键能/kJ•mol-1 | 436.0 | 946 | 390.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
科目: 来源: 题型:解答题
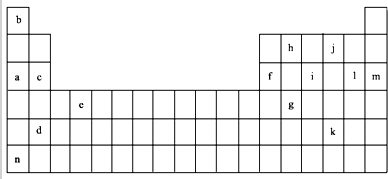
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com