
科目: 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 平衡时甲、乙中Z的体积分数甲>乙 | |
| B. | 平衡时甲中X的转化率为75% | |
| C. | 达到平衡后,再向乙中加入0.25molX,0.75molY和1.5molZ,平衡向生成x的方向移动 | |
| D. | 乙中反应的热化学方程式:2Z(g)═X(g)+3Y(g)△H=+Q2kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:| 资料1 |
| ||||||||||||
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. |
查看答案和解析>>
科目: 来源: 题型:解答题
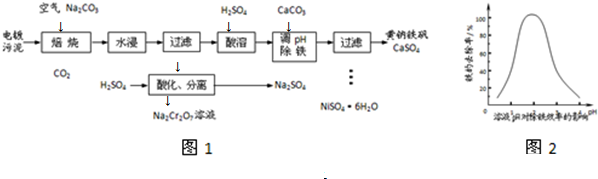
查看答案和解析>>
科目: 来源: 题型:解答题
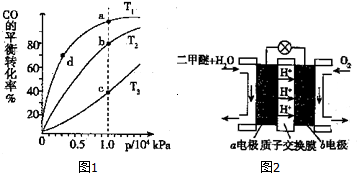
| 容器 | c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)和v(逆)大小比较 |
| I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v 正)< v(逆)(填>、<、=) |
查看答案和解析>>
科目: 来源: 题型:解答题
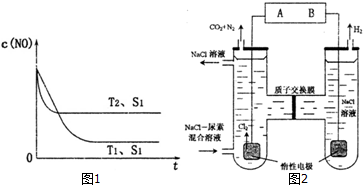
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 如图所示的装置,C、D、E、F、X、Y都是惰性电极.接通电源后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:
如图所示的装置,C、D、E、F、X、Y都是惰性电极.接通电源后,向乙中滴入酚酞溶液,在F极附近显红色.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com