
科目: 来源: 题型:多选题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目: 来源: 题型:解答题
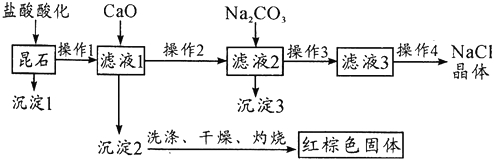
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q1=Q2=Q3=57.3 | B. | Q1>Q2>Q3>57.3 | C. | Q3<Q1<Q2=57.3 | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2 | B. | CO | C. | C12H22O11 | D. | C6H12O6 |
查看答案和解析>>
科目: 来源: 题型:填空题
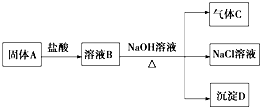
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 硫是氧化剂,KOH是还原剂 | |
| B. | 反应中共转移4摩尔电子 | |
| C. | 还原剂和氧化剂质量比是1:2 | |
| D. | 氧化产物和还原产物的质量比是1:2 |
查看答案和解析>>
科目: 来源: 题型:填空题
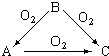 常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.
常温下某淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有如图的转变关系,请回答:(1)A是S、B是H2S、C是SO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com