
科目: 来源: 题型:选择题
| A. | 该溶液中,Na+、Fe3+、NO3-、Cl-可能大量共存 | |
| B. | 和溴水反应的离子方程式:Br2+SO32-+H2O=2H++2Br-+SO42- | |
| C. | 和Ba(OH)2溶液加热反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 1L0.1mol•L-1该溶液和足量的硝酸充分反应,生成2.24L(标准状况)SO2气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
 苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )
苯甲酸叶醇酯存在于麝香、百合和水仙花中,可用于高档香水的香精配方中,留香时间超过两周,其结构简式如图所示,下列关于苯甲酸叶醇酯的说法中错误的是( )| A. | 苯甲酸叶醇酯能发生氧化反应 | |
| B. | 苯甲本叶醇酯能使溴的四氯化碳溶液褪色 | |
| C. | 1mol苯甲酸叶醇酯最多能与4molH2发生加成反应 | |
| D. | 1mol苯甲酸叶醇酯与NaOH溶液反应时,能消耗2molNaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氯丙烷有三种同分异构体 | |
| B. | 碳酸氢钠可用作食品加工中的无铝发泡剂,快速发酵粉 | |
| C. | 二氧化碳制全降解塑料有助于控制温室效应和白色污染 | |
| D. | 某化合物的分子式为C8H10O,其中能与乙酸发生酯化反应的同分异构体有4种 |
查看答案和解析>>
科目: 来源: 题型:解答题
 利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.
利用硫酸工业尾气中的二氧化硫可以制取氮肥硫酸铵.某探究小组设计实验对制得硫酸铵的品质进行鉴定.| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
| 滴定次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 1.20 | 18.91 |
| 2 | 0.00 | 18.60 |
| 3 | 1.10 | 18.79 |
查看答案和解析>>
科目: 来源: 题型:填空题
 周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1.
周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1.查看答案和解析>>
科目: 来源: 题型:选择题
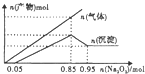
| A. | 混合溶液中m(Al3+)为5.4g | B. | 混合溶液中c(Mg2+)为0.5mol/L | ||
| C. | 混合溶液的pH=2 | D. | 混合溶液中c(Cl-)为1.7mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| 弱酸化学式 | HCN | H2CO3 |
| 电离平衡常数(25℃) | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | Na2CO3溶液中滴入等体积、等浓度的盐酸后,溶液中一定存在:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-) | |
| B. | Na2CO3溶液中通一定量的CO2气体后,溶液中一定存在:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | Na2CO3溶液加水稀释后,c(H+)增大 | |
| D. | Na2CO3溶液中加入过量HCN,反应方程式为:Na2CO3+HCN=NaHCO3+NaCN |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硅胶作干燥剂是利用其多孔、吸附水分的能力强 | |
| B. | 铝在空气中必须出良好的抗腐蚀性,说明铝极难与氧气反应 | |
| C. | 明矾可用于饮水的消毒杀菌 | |
| D. | 光导纤维比普通电缆有更强的传输信息能力,是因为其导电能力强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol Na2O和Na2O2的混合物中,阴阳离子总数为3NA | |
| B. | 非标准状况下,NA个CO2分子所占的条件不可能为22.4L | |
| C. | 24.4gNa2O•SiO2中含有0.2NA个SiO2分子 | |
| D. | 56gFe投入1000mL3.5mol•L-1稀硝酸中,充分反应,转移电子总数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 离子或分子 | 要求 |
| A | Mg2+、SO42-、Cl-、NO3- | c(Mg2+)=c(SO42-) |
| B | Na+、Cu2+、I-、NH3•H2O | 在酸性高锰酸钾溶液中 |
| C | NH4+、Al3+、Cl-、NO3- | 滴加氨水有沉淀产生 |
| D | Cl-、Na+、Cr2O72-、C2H5OH | 溶液无色透明且遇甲基橙显红色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com