
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 是银白色质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl(OH)3一定是两性氢氧化物 | D. | 单质铊的还原性一定比单质铝强 |
查看答案和解析>>
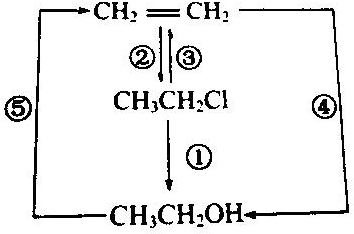
科目: 来源: 题型:解答题
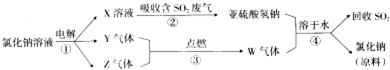
查看答案和解析>>
科目: 来源: 题型:解答题
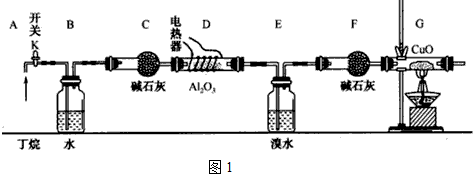
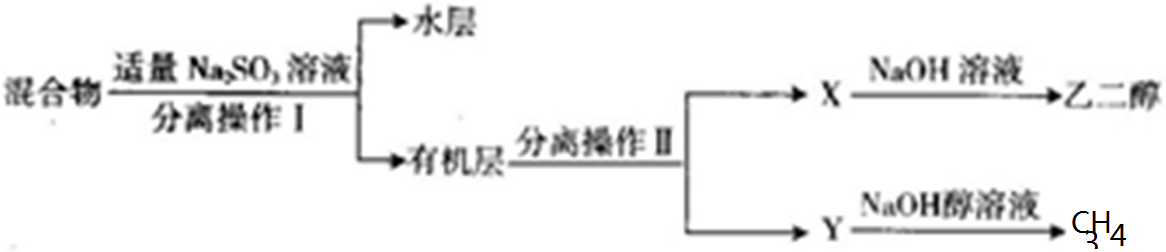
查看答案和解析>>
科目: 来源: 题型:选择题
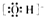
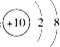

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目: 来源: 题型:解答题
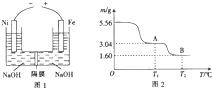 铝、铁及其化合物在工业生产中有着重要的应用.
铝、铁及其化合物在工业生产中有着重要的应用.查看答案和解析>>
科目: 来源: 题型:选择题
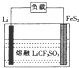 Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )
Li-FeS2电池是目前电池中综合性能最好的一种电池,其结构如图所示,已知电池放电时的反应为4Li+FeS2=Fe+2Li2S.下列说法正确的是( )| A. | Li为电池的正极 | |
| B. | 电池工作时,Li+向负极移动 | |
| C. | 正极的电极反应式为FeS2+4e-=Fe+2S2- | |
| D. | 将熔融的LiCF2SO4改为LiCl的水溶液,电池能更好 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子的半径:r(A)<r(C)<r(D)<r(E) | |
| B. | 元素B的最简单气态氧化物的稳定性比C的强 | |
| C. | D2C2与A2C2的漂白原理相同 | |
| D. | 元素E的氧化物能溶于B或D的最高价氧化物对应的水化物中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com