
科目: 来源: 题型:选择题
| A. | 饮用牛奶和豆浆可以缓解重金属引起的中毒 | |
| B. | 向煤中加入适量石灰石,可减少其燃烧产物中的SO2,降低对大气的污染 | |
| C. | 食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 | |
| D. | 混凝法、中和法和沉淀法是污水处理中常用的化学方法 |
查看答案和解析>>
科目: 来源: 题型:解答题
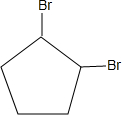 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$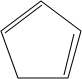 +2NaBr+2H2O;
+2NaBr+2H2O;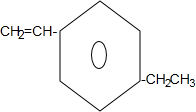 .
.查看答案和解析>>
科目: 来源: 题型:填空题
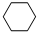 (g)$\stackrel{催化剂}{?}$
(g)$\stackrel{催化剂}{?}$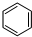 (g)+3H2(g)△H
(g)+3H2(g)△H
查看答案和解析>>
科目: 来源: 题型:填空题
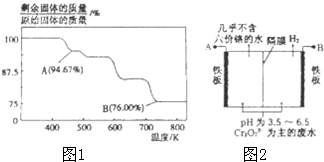 CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.
CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料.CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图1所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 燃着的酒精灯不慎碰到失火,应立即用湿布盖灭 | |
| B. | 酸碱中和滴定实验中,滴定管和锥形瓶都要用待装溶液润洗 | |
| C. | 用浓氨水洗涤做过银镜反应的试管 | |
| D. | 测某溶液的pH时,将pH试纸浸入待测溶液中,过一会儿取出,与标准比色卡进行对比 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2O3常用作红色油漆和涂料 | B. | 氟氯烃是安全、环保的制冷剂 | ||
| C. | 聚丙烯酸钠可做“尿不湿”原料 | D. | 硅胶可用作瓶装药品干燥剂 |
查看答案和解析>>
科目: 来源: 题型:填空题

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目: 来源: 题型:解答题
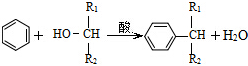
 (-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾
(-R表示烃基)D$\stackrel{KOH}{→}$苯甲醇+苯甲酸钾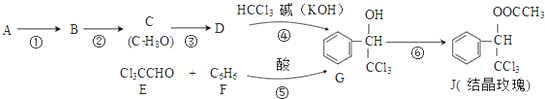
 .
. ,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.
,则经反应路线⑤得到一种副产物,其核磁共振氢谱有4种峰,各组吸收峰的面积之比为1:2:4:4.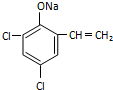 或
或 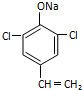 (只写一种).
(只写一种).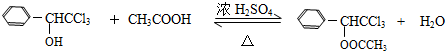 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
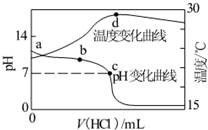 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | 氨水的电离程度a>b>c | |
| B. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) | |
| C. | c点时消耗盐酸体积V(HCl)<20.00mL | |
| D. | d点时溶液温度达到最高,之后温度略有下降,原因是NH3•H2O电离吸热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com