铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe
3C).X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是
Fe2+、Fe3+、H+
Fe2+、Fe3+、H+
.
(2)某溶液中有Mg
2+、Fe
2+、Al
3+、Cu
2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
B、C
B、C
;
A.Mg
2+ B.Fe
2+C.Al
3+ D.Cu
2+(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如图1:
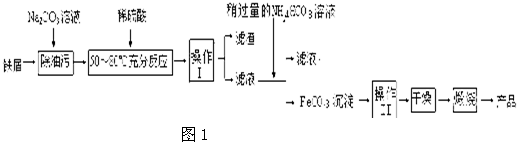
回答下列问题:
①操作Ⅰ的名称是
过滤
过滤
,操作Ⅱ的名称是
洗涤
洗涤
.
②写出在空气中煅烧FeCO
3的化学方程式
;
(4)有些同学认为KMnO
4溶液滴定也能进行铁元素含量的测定(5Fe
2++MnO
4-+8H
+═5Fe
3++Mn
2++4H
2O).
a.称取2.850g绿矾(FeSO
4?7H
2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO
4溶液滴定至终点,消耗KMnO
4溶液体积的平均值为20.00mL.
①实验前,首先要精确配制一定物质的量浓度的KMnO
4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
250 mL容量瓶
250 mL容量瓶
.
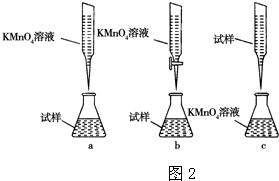
②某同学设计的下列滴定方式(如图2),最合理的是
b
b
.(夹持部分略去)(填字母序号)
③计算上述样品中FeSO
4?7H
2O的质量分数为
0.975
0.975
.


