
科目: 来源: 题型:选择题
| A. | 燃烧一定要用火去点燃 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界.这一完美结合现实与理论的化学系统模型,为更全面了解并预测化学反应进程奠定了基础 | |
| D. | 化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 | |
| B. | 过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率 | |
| C. | 电解质溶液导电的过程中,一定发生了电解质溶液的电解 | |
| D. | 溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
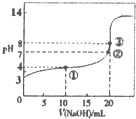 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液变化),pH变化曲线如图所示(忽略温度),以下叙述正确的是( )| A. | 根据图中数据可计算出K值约为1×10-5 | |
| B. | ①②③点水的电离程度由大到小的顺序为:②>③>① | |
| C. | 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 点③时c(CH3COOH)+(CH3COO-)=0.1mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铁溶液、溴水 | B. | 碳酸钠溶液、溴水 | ||
| C. | KMnO4酸性溶液、溴水 | D. | KMnO4酸性溶液、氯化铁溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOCCOOH | D. | (CH3)3CCOOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al 1s22s22p63s23p1 | B. | O2- 1s22s22p4 | ||
| C. | Na 1s22s22p63s1 | D. | F 1s22s22p5 |
查看答案和解析>>
科目: 来源: 题型:选择题
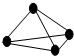 原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )
原子间以共价单键相连的非金属单质中,一个原子与相邻原子的成键数为8-N,N为该非金属元素的族序数,化学家把这一现象称为8-N规则.某非金属单质的结构如图所示,则构成该单质的元素位于( )| A. | ⅢA | B. | ⅣA | C. | ⅤA | D. | ⅥA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡 | |
| B. | 静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体) | |
| C. | 打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 | |
| D. | 最后继续打开活塞,另用容器承接并保存上层液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com