
科目: 来源: 题型:选择题
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
查看答案和解析>>
科目: 来源: 题型:选择题
 H]-
H]-

| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
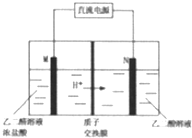 乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.工业上用“双极室成对电解法”生产乙醛酸,原理如图所示.该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | N电极上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CH0+H2O | |
| B. | 若有2molH+通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1mol | |
| C. | M电极上的电极反应式为:2Cl--2e-═Cl2↑ | |
| D. | 乙二醛与M电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O═HOOC-CHO+2HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
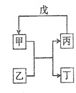 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | O2 | NO | H2O |
| B | Fe | H2O | H2 | Fe2O3 |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| D | Na2O2 | CO2 | O2 | Na |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾与漂白粉常用于自来水的净化与消毒,这两者的作用原理是一样的 | |
| B. | 为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放生石灰 | |
| C. | 海轮外壳上镶入锌块,可减缓船体的腐蚀,该方法叫牺牲阳极的阴极保护法 | |
| D. | 酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的 |
查看答案和解析>>
科目: 来源: 题型:选择题
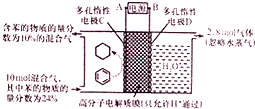 一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )
一定条件,如图所示装置可实现有机物的电化学储氢(忽略其他有机物).下列说法中不正确的是( )| A. | 导线中电子转移方向为C到A | |
| B. | 阳极生成2.8mol气体时,转移电子为11.2mol | |
| C. | 生成目标产物的电极反应式为C6H6+6H++6e-=C6H12 | |
| D. | 该储氢装置的电流效率η=64.3%(η=$\frac{生成目标产物消耗的电子数}{转移的电子总数}$×100%) |
查看答案和解析>>
科目: 来源: 题型:解答题
 Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Z、W、M的原子半径由大到小的顺序为Z>W>M | |
| B. | M分别与Z、W所形成的物质的晶体类型相同 | |
| C. | X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键 | |
| D. | 将Z2Y在空气中加热可得到Z2Y2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com