
科目: 来源: 题型:解答题
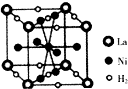 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填序号),HCHO分子的立体结构为平面三角形;HC≡CH分子内σ键与π键个数之比为3:2.查看答案和解析>>
科目: 来源: 题型:解答题
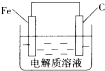 铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷自燃而氮气在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 常温下将Al片放入浓硝酸中无明显变化 | Al与浓硝酸不反应 |
| B | 加热滴有酚酞的醋酸钠溶液,溶液红色变深 | 加热促进CH3COO-水解,溶液的碱性增强 |
| C | 将溴水分别滴入植物油和裂化汽油中,溴水均褪色 | 前者由于萃取而褪色,后者由于发生加成反应而褪色 |
| D | 加热NaHCO3溶液无明显变化 | NaHCO3的热稳定性强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
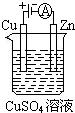 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 四种元素中,元素Z的非金属性最强 | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | Y、Z、W三种元素的原子半径大小顺序:r(Z)>r(W)>r(Y) | |
| D. | YW3、ZW2、Z2W2中各原子最外层均达到8电子稳定结构 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| B. | 溶液中含大量Al3+:HClO、HCO3-、ClO-、CO32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验组 | 温度/C | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com