
科目: 来源: 题型:选择题
| A. | 大量开发利用深海可燃冰,有助于海洋生态环境的治理 | |
| B. | 汽车尾气中含有大量大气污染物,其原因是汽油不完全燃烧造成的 | |
| C. | 煤炭燃烧过程安装固硫装置,目的是提高煤的利用率 | |
| D. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 |
查看答案和解析>>
科目: 来源: 题型:选择题
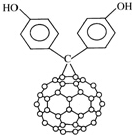 由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )
由于C60具有碳碳双键所以又名为“足球烯”;C60的二苯酚基化合物结构如图.下列关于C60的二苯酚基化合物的叙述正确的是( )| A. | C60的二苯酚基化合物属于芳香烃 | |
| B. | C60的二苯酚基化合物分子式为C73H12O2 | |
| C. | C60的二苯酚基化合物能与氢氧化钠溶液反应 | |
| D. | 1mol C60的二苯酚基化合物最多可以与6mol H2发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
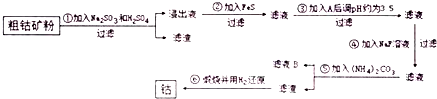
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤 | 有难溶物存在 |
| 步骤2: | ①有无色气泡产生,说明有CaCO3 ②出现无色气泡,说明含有碳酸钙,说明有若有难溶物存在,说明有二氧化硅 |
| 步骤3: | |
| … |

查看答案和解析>>
科目: 来源: 题型:解答题
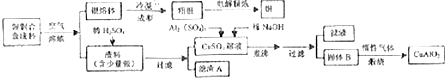
查看答案和解析>>
科目: 来源: 题型:选择题
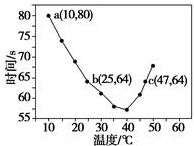
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中a点对应的NaHSO3反应速率为5.0×10-5 mol•L-1•s-1 | |
| C. | 图中b、c两点对应的NaHSO3反应速率相等 | |
| D. | 40℃之后,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
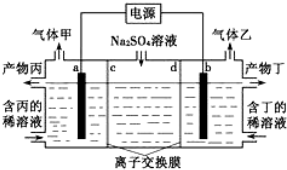
| A. | a电极反应式:2H++2e-=H2↑ | |
| B. | 产物丁为NaOH | |
| C. | c为阳离子交换膜 | |
| D. | 每转移0.2mol电子,产生1.12L气体甲 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②⑤ | B. | ①②③ | C. | ①②③⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com